|
|
||||||
|
retour plan du cours de TS, accueil, programme TS 2004, panorama |
|
|||||
|
Plan |
|
|||||
|
Bases connues : cours de 1ère S (comparaison système immunitaire / système nerveux ; deux systèmes de relation) |
||||||
|
2. Le SIDA est une
maladie du système génétique des
cellules immunitaires
|
Tout comme il a été rappelé dans l'ancien cours de TS, je précise que cette partie n'a pas pour but l'étude exhaustive d'une maladie, mais bien l'étude de la réponse de l'organisme dans le cas d'un exemple, à partir duquel nous généraliserons. |
|||||
|
Sources |
||||||
|
il existe deux VIH |
La pandémie d'infection à VIH (virus de l'immunodéficience humaine, HIV en anglais) et donc du SIDA (syndrome immunitaire de déficience acquise), qui désigne la maladie associée à cette infection, est essentiellement liée au VIH-1 (98% des cas). |
Il existe un autre type de virus, le
VIH-2,
que l'on trouve principalement dans certains pays d'Afrique
occidentale ). Il existe des sous-types (variants génétiques) de ces deux virus. |
Le pronostic d'une infection par le VIH-2 est meilleur que pour le VIH-1. L'évolution est plus lente, probablement en raison d'une réplication virale moins importante. De même, le risque de transmission du VIH-2 est plus faible que celui du VIH-1, que ce soit par voie sexuelle ou de la mère au fœtus. |
|||
|
|
||||||
|
les virus sont des assemblages nucléoprotéiques organisés.
Cours seconde: |
Les virus ne sont pas des êtres vivants, car ils ne présentent aucun des trois types de travail qui définissent le vivant: ni travail de relation (pas d'échange ni de matière ni de signal..., pas de mouvement), ni travail de nutrition (aucun métabolisme: aucun échange d'énergie ni de matière), ni travail de reproduction (une cellule procaryote ou eucaryote vivante peut multiplier la particule virale, mais on ne peut pas vraiment dire que c'est le virus qui se multiplie... en tout cas, il ne peut le faire sans cellule vivante). |
Une particule virale n'est pas une cellule (et selon la théorie cellulaire, ce n'est donc pas un être vivant, voir cours de seconde). On peut aussi noter qu'aucun virus ne possède des ARN et ADN simultanément, ce que possèdent toutes les cellules.
TD seconde : Les acides nucléiques
|
Les virus sont connus sous deux
formes: |
|||
|
|
|
|||||
|
|
||||||
|
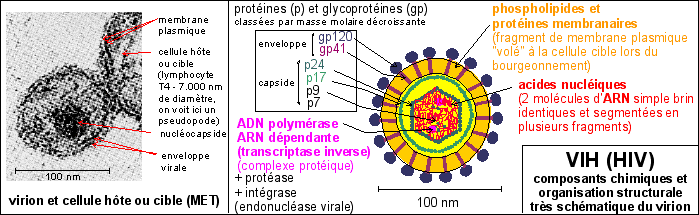
Remarque: |
La glycoprotéine gp
120 a une masse (ou poids moléculaire) de
120kDa. Le dalton, qui est la masse
d'un atome d'hydrogène, vaut 1,67.10-24g.
Il est symbolisé par Da. Le kilodalton s'écrit
kDa et correspond à 1000Da. On
peut donc dire que la molécule gp120 a une masse
correspondant à 120.000 atomes d'hydrogène...
Les protéines de moins de 20kDa sont
considérées comme petites. La gp120 et la gp
41 sont de grosses
protéines. |
La taille des protéines
dépend bien évidemment de leur degré de
repliement. Une chaîne d'aa de conformation bêta
a environ un diamètre de 0,5 nm en supposant qu'elle
est droite. Une hélice de type alpha aurait un
diamètre d'environ 1,1 nm. Une molécule de
sérumalbumine bovine de 64500 Da possède 584
aa et une fois repliée sous forme globulaire a
environ la forme d'un bâtonnet de 3 nm de
diamètre sur 13 nm de long (si elle était
uniquement sous une forme bêta, elle formerait une
chaîne de 200 nm ou une hélice de 90 nm de long
sous une forme alpha). |
Enfin de très nombreuses protéines sont glycosylées, c'est-à-dire qu'elles possèdent des résidus glucidiques: ce sont des glycoprotéines (comme la gp120 ou la gp41).` On peut aussi souligner, ce qui a été remarqué par de nombreux auteurs, que les protéines intracellulaires ont une taille relativement homogène (40 nm3 de volume pour un diamètre moyen de 3,5 nm), ce qui est mis en rapport avec la structure aqueuse de la cellule (voir P. Mentré, l'eau dans la cellule, §6.4 p 126), l'eau étant regroupée en microdomaines (clusters) d'une dimension voisine de celle des sous-unités protéiques.
TD première S : aa et protéines cours de 1ère S: les protéines |
|||
|
|
||||||
|
structure du virion |
Le VIH, virus de l'immunodéficience humaine (HIV en anglais, human immonodificiency virus), est un assez gros virus avec ses 100nm de diamètre (les plus petits virus, comme le virus de la poliomyélite, sont de la taille d'un ribosome - 20/30 nm -, les plus grands -comme le virus de la vaccine ou celui des oreillons - atteignent 300 à 400 nm dans leur plus grande dimension). |
Le virion est
composé : |
Remarque: |
|||
|
le provirus |
L'ARN du virion est qualifié de chaîne positive, car il possède la même séquence que l'ARNm viral qui code pour les protéines de la capside (les virus à ARN simple brin positif (ou rétrovirus) sont rétrotranscrits en ADN grâce à leur propre transcriptase inverse, alors que les virus à ARN à simple brin négatif peuvent être traduits à partir d'un ARN synthétisé par une transcriptase virale: il n'y a pas de passage par un provirus à ADN). Le provirus est de petite taille (environ 9.700.000 bases), ce qui correspond à la possibilité d'une information pour moins d'une dizaine de protéines. Cependant, une même séquence peut être lue de plusieurs façons et donc donner lieu à plusieurs protéines différentes, ce qui augmente la quantité d'information génétique contenue dans le provirus. |
|||||
|
|
provirus du VIH et protéines synthétisées par la cellule hôte à partir du provirus (aucun stade provirus sous la forme ARN viral ou ARNm n'est représenté...) |
|||||
|
Pour la notion de
système génétique voir le cours de
1èreS: |
On trouve parfois l'appellation "génome" du VIH, mais le virus n'étant pas une cellule (ni un être vivant) et la notion de gène moléculaire étant strictement cellulaire (voir cours de 1èreS) le terme "génome viral" est une appellation indue; il s'agirait plutôt des gènes spécifiques (ou gènes parasites) d'une cellule infectée par le VIH (voir page sur les génomes). Ces gènes n'existent que dans une cellule infectée (le SIDA est à cet égard une maladie du système génétique des cellules immunitaires). Le terme provirus regroupe les différentes formes intracellulaires du virus (ARN simple brin, ADN simple brin ou ADN double brin prêt à s'insérer dans le génome cellulaire). |
On notera que certains gènes sont chevauchants et qu'une séquence d'ADN peut donc correspondre à plusieurs gènes différents suivant les maturations des ARNm (épissage alternatif) ou des protéines issues de la traduction (qui peuvent être coupées de plusieurs façons par les enzymes protéolytiques). De même, certains gènes régulateurs sont emboîtés, car ils peuvent donner naissance à une protéine régulatrice ou à une autre selon le cadre de lecture utilisé. |
||||
|
|
||||||
|
L'intégrase virale est une endonucléase (voir ce nom dans le cours de spécialité) qui coupe l'ADN nucléaire de la cellule cible et insère le provirus-ADN au sein du génome cellulaire. Il semblerait que dans le cas du VIH le provirus puisse s'insérer en un point quelconque du génome de la cellule hôte. Ce qui explique peut-être la destinée de cet ADN viral intégré: il peut rester quiescent - inactif (ou non activé par la cellule)- soit être exprimé (transcrit puis traduit) et donner de nouvelles particules virales. |
La transcriptase inverse ou transcriptase reverse est une enzyme découverte chez les rétrovirus par Temin en 1962 et Baltimore en 1970 alors qu'elle était découverte par Beljanski et ses collaborateurs chez des procaryotes (Escherichia coli puis Agrobacterium tumefaciens) en 1972 puis 1974 puis chez un premier eucaryote (Neurospora crassa, un mycète) en 1977. Enfin, cette équipe a découvert des transcriptases réverse chez des œufs de poisson en 1988. Depuis on en est venu à considérer que le passage ARN vers ADN est un mode courant de transfert d'information qui pourrait notamment jouer un rôle essentiel lors du développement (quelques éléments historiques sont sur la page d'histoire de la génétique, mais on peut aussi citer d'autres travaux beaucoup plus récents et plus généraux sur le rôle des ARN comme ceux référencés sur la page d'accueil). Les transcriptases réverses
virales contiennent du Zn2+ comme toutes les ADN
et ARN polymérases. Elles sont surtout actives avec
de l'ARN appartenant à leur propre type de virus,
mais elles ont permis, in vitro, de synthétiser des
ADN à partir d'ARN divers (ARNm, ARNs ou ARNt...).
Elles catalysent 3 types de réactions
simultanément: |
On obtient donc un ADN double brin
(dit ADN complémentaire ou cADN) à partir d'un
ARN monobrin qui est détruit. On note que la
transcriptase inverse virale présente un taux
d'erreur assez élevé ce qui détermine
une variabilité* virale
importante. Pour une
transcriptase réverse virale on obtient in vitro le
chiffre de 1 nucléotide erroné sur 20.000
nucléotides; que l'on peut comparer à celui
d'une ADN polymérase in vitro qui est habituellement
de 1/10.000 à 1/100.000; fréquence d'erreur
notablement réduite in vivo, à moins de
1/109, notamment par des mécanismes de
réparation appelés édition ou
correction des épreuves). Dans
le cas du VIH la transcriptase réverse semble
même avoir un taux d'erreur dix fois plus important,
ce qui donne lieu à une ou deux erreurs de copie par
réplication, ce qui ferait que chaque particule
virale serait, en pratique, différente des autres.
|
||||
|
|
||||||
|
antiviraux |
La lutte contre le VIH se fait
essentiellement à l'aide
d'inhibiteurs de
la transcriptase réverse
virale. |
Un désoxyribo- ou ribo- nucléoside est composé de la base (ici la thymine (T)) et d'un sucre (désoxyribose ou ribose). Un nucléotide comporte en plus un, deux ou trois phosphates donnant respectivement des désoxyribo- ou ribo- nucléotides mono-, di- et tri- phosphate. Le dTTP, forme triphosphate de ce nucléotide est utilisé pour la synthèse d'ADN.
TD seconde : Les acides nucléiques |
||||
|
|
||||||
|
2.2.1 Les VIH sont des virus assez peu
résistants qui se transmettent chez les
Mammifères principalement par le biais de
sécrétions
|
||||||
|
transmission |
On connaît la facilité de transmission de certains virus rhinopharyngés ou du virus de la grippe. Il suffit d'une poignée de main, d'un éternuement non réprimé, d'une serviette humide... pour transmettre ces virus (et certaines bactéries). Le VIH ne se transmet pas aussi facilement. Il est inactivé rapidement à l'air libre et encore plus vite par un simple contact avec un linge imprégné d'alcool à 60°. Il ne se transmet pas par les aérosols ni directement par contact avec la peau. |
Le VIH ne "survit" pas longtemps en dehors des cellules. Le mode habituel de transmission est donc l'échange de fluides contenant des cellules vivantes infectées: sang, sperme, sécrétions vaginales, salive, lait maternel... Cependant, vous comprendrez que, devant une pandémie (épidémie généralisée au monde entier ou au moins à un grand nombre de populations), il soit nécessaire d'être prudent, et que l'on ne puisse pas écarter toute possibilité de transmission par des fluides dépourvus de cellules...mais dans ces cas il ne s'agit pas alors du mode habituel de transmission, mais de cas rares. |
||||
|
2.2.2 Les VIH pénètrent dans les
cellules présentant la molécule CD4 et qui
sont donc leurs cellules cibles
|
||||||
|
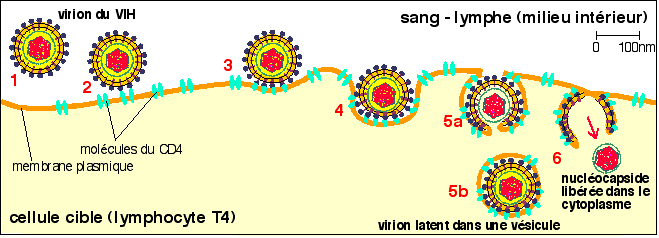
pénétration dans les cellules-cibles |
Le principal récepteur des VIH est la molécule CD4. La molécule CD4 (voir ci-dessus) est une glycoprotéine transmembranaire avec 4 domaines extracellulaires de type Ig (voir ci-dessus pour la structure des Ig). La partie N-terminale de la chaîne D1 de chaque Ig interagit avec une région formée des 4 parties constantes de la gp120 du virus. L'interaction gp120-CD4 provoque une insertion de la région hydrophobe de gp41 (qui est liée à al gp120) dans l'enveloppe lipidique et la fusion virus-cellule cible (schéma ci-dessous). |
Les molécules
CD4 sont
exprimées |
Il suffit qu'une cellule possède quelques molécules CD4 -voire une seule- pour qu'elle puisse être infectée par le VIH. Donc, les points d'entrée du virus sont le sang ou la lymphe (où l'on trouve à la fois les LT et les monocytes) - et donc nécessitant une blessure pour s'échanger (une piqûre avec une seringue est une blessure)-, les muqueuses (où l'on trouve les macrophages et les cellules dendritiques) - pour lesquelles un contact suffit -, les sécrétions (où l'on trouve des macrophages) - par contact aussi -... Remarque: |
|||
|
|
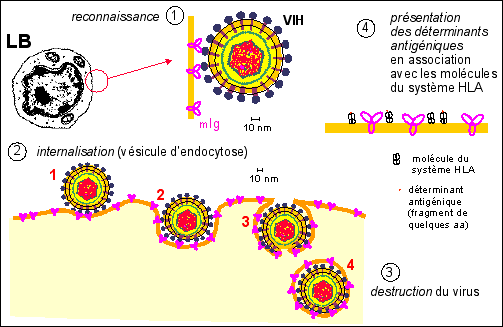
L'endocytose du virion du VIH par une cellule cible 1-arrivée du virion; 2-reconnaissance gp120-molécules du CD4; 3-modification de la conformation de la gp41 qui entre dans la bicouche lipidique de l'enveloppe virale; 4- début de formation d'une vésicule d'endocytose autour du virion; 5a-début de fusion de l'enveloppe virale avec la membrane plasmique de la cellule cible; 5b-formation d'une vésicule d'endocytose complète dans lequel le virion peut se maintenir à l'état latent (phase de latence); 6-libération de la nucléocapside dans le cytoplasme et début de la phase productrice du virus. |
|||||
|
endocytoses facilitées |
Paradoxalement, les Ac anti-gp120 peuvent favoriser la pénétration du VIH, notamment au niveau des macrophages qui peuvent internaliser ainsi le virion recouvert d'Ac. De même, le virion opsonisé par le complément (voir ci-dessus) peut être internalisé par des cellules porteuses de la molécule CD3 (phagocytes, LB, cellules dendritiques folliculaires). |
D'autres molécules comme les gangliocéramides de la surface des cellules de lignées épithéliales (intestinales, vaginales) et nerveuses pourraient servir de récepteur et lier la gp120. Toutes les souches virales infectent les LT-CD4+ in vitro. Certaines souches sont cependant plus ou moins virulentes pour telle ou telle lignée cellulaire. |
Le pouvoir pathogène (du grec pathos = souffrir) du virus repose d'abord sur la cytotoxicité : si sa réplication est intense, le VIH provoque la lyse de la cellule infectée. |
|||
|
2.2.3 Le système immunitaire s'oppose à la pénétration du virus |
||||||
|
réaction inflammatoire |
Les mécanismes immunitaires qui s'opposent à l'infection par le virus sur le site de pénétration sont regroupés sous le terme général de réaction inflammatoire. Ils dépendent évidemment de la forme introduite, du nombre de particules virales et surtout de la répétition éventuelle de la contamination. Pendant la phase locale, les mécanismes sont rapides et non spécifiques, ils ne mettent pas en jeu la mise en mémoire d'un Ag spécifique et l'activation de systèmes adaptés spécifiquement à cet Ag. On parle aussi d'immunité innée par opposition à l'immunité acquise qui intervient dans la réaction généralisée.
|
Si le virion est libre, il peut
être |
Si le virion est dans une cellule
étrangère infectée, le
système immunitaire peut d'abord reconnaître la
cellule elle-même comme une cellule
étrangère grâce à la
fixation d'Ac
à sa surface
(reconnaissance d'Ag étrangers
par les Ac circulants qui seraient dirigés
naturellement, sans "éducation", vers de nombreux Ag
étrangers - ce qui fait partie de ce que l'on nomme
le répertoire
immunitaire). Cette fixation
entraînerait l'activation de la fraction lytique
du complément et
la lyse
de la cellule
infectée, ce qui aurait pour
conséquence de libérer les virions ou les
provirus et d'activer les mécanismes
précédents. Ce mécanisme est aussi
invoqué pour expliquer la présence dans le
sang du sujet contaminé de virions libres et des
fragments de virus (ARN, protéines...).
|
|||
|
|
||||||
|
Pendant cette phase d'inflammation, il est aussi possible que le virus pénètre dans ses cellules cibles et soit immédiatement répliqué par la cellule. Mais ceci semble peu probable étant donné que l'on pense qu'il y a toujours une phase de latence (voir ci-dessous) qui suit la pénétration du virus. |
Un phagocyte (comme un globule blanc de type granulocyte neutrophile ou encore un macrophage) est normalement capable de DÉTRUIRE le virus et il y arrive sans doute. Mais cela ne veut pas dire qu'il le détruise TOUJOURS et surtout qu'il détruise TOUS les virus qui ont pénétré. |
Les interférons sont un groupe de substances antivirales sécrétées par les globules blancs, les lymphocytes T activés et les cellules NK . Ces molécules bloquent la traduction des protéines virales dans les cellules hôtes et stimulent la synthèse des molécules HLA présentant les peptides viraux au système immunitaire. Les interférons stimulent aussi la lyse directe par les cellules NK des cellules infectées par les virus. |
||||
|
|
||||||
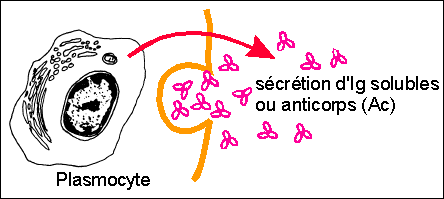
|
Le terme ne semble plus guère employé dans les nouveaux manuels, mais il désignait la réponse médiée (réalisée) par les Ac sécrétés par les plasmocytes (voir les cellules immunitaires). Les Ac étant des substances chimiques circulant dans les humeurs (sang lymphe)...
 Les Ac font partie des immunoglobulines (Ig) - voir page précédente |
À l'extrémité des deux bras de l'Y que forme la molécule d'Ig il y a deux sites antigéniques identiques dont le grand polymorphisme de séquence des aa qui le composent permet une liaison spécifique avec un Ag. La fixation d'une ou plusieurs molécules d'Ac à un Ag forme un complexe immun qui, dans le cas d'une toxine ou d'un virus de petite taille, permet de neutraliser l'Ag, c'est-à-dire qu'il empêche le pouvoir pathogène de s'exprimer (par encombrement spatial par exemple dans le cas d'une toxine ou par empêchement d'un virus à se fixer aux récepteurs membranaires qui lui permettent de pénétrer dans une cellule hôte). Les complexes immuns sont ensuite phagocytés (voir ci-dessus les étapes de la phagocytose) par les neutrophiles ou les macrophages, notamment grâce à la deuxième partie de la molécule d'Ac |
 complexe immun VIH + 11 Ac (le VIH fait environ 100 nm de diamètre et chaque Ac 15 nm de hauteur) |
||||
|
|
||||||
|
La partie verticale de l'Y que forme la molécule d'Ac est une partie de séquence peu variable (dite partie commune à tous les Ac) qui intervient dans deux rôles : |
* Elle peut se fixer à des
récepteurs situés à la surface des
macrophages et favoriser la phagocytose. |
|||||
|
|
||||||
|
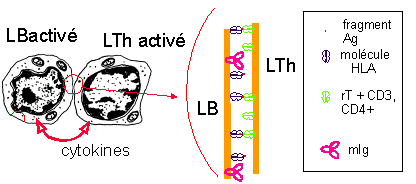
mise en place de la réponse immunitaire spécifique |
activation directe des LB
Les LB présentent ensuite des fragments (environ 9aa) des peptides de ce virus en association avec leurs molécules du système HLA (voir page précédente pour ces molécules): c'est la présentation des déterminants antigéniques. |
|
||||
|
Je conseille la vidéo disponible sur la page de l'INRP sur les 50 premières heures de la réponse immune après injection d'un antigène (bien sûr sans rapport direct avec le VIH), même s'il ne s'agit que d'une ANIMATION et non d'une série de clichés pris en temps réel, comme on pourrait le penser: http://acces.inrp.fr/acces /ressources/sante /agents-infectieux-et-defenses- de-lorganisme/ comprendre/ immunologie/ reponses-immunitaires /50heures |
coopération
cellulaire LB-LTh
|
|
||||
|
*La coopération pourrait se faire
dans l'autre sens par un LT activé au niveau de la
zone de pénétration du virus par des cellules
infectées jouant le rôle de CpAg (mais ce
mécanisme n'est pas au programme de terminale). Dans
ce cas ce mécanisme se passerait dans le cortex
superficiel des ganglions lymphatiques.
|
||||||
|
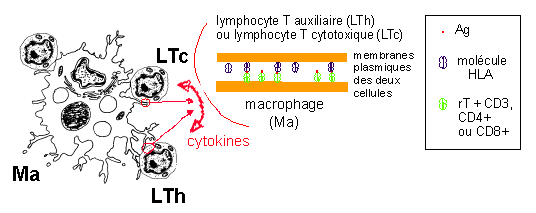
coopération cellulaire Ma-LT |
activation simultanée des
LTh et LTc par un
macrophage
infecté par le VIH
Les récepteurs T (rT) et le complexe CD3 des lymphocytes T effectuant alors une double reconnaissance des molécules HLA et de l'Ag. On parle d'activation ou de reconnaissance restreinte au CMH, car les molécules HLA sont indispensables à la reconnaissance de l'Ag par les rT. Cette coopération cellulaire Ma-LT peut avoir lieu dans les tissus, mais préférentiellement dans les ganglions lymphatiques (voir phase suivante). |
|
||||
|
Remarque: |
Les LTh activés
sécrètent des
cytokines
activatrices.> |
|||||
|
Les LTc activés sont capables de lyser des cellules infectées (et notamment les macrophages). |
||||||
|
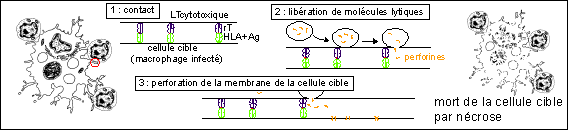
|
Une représentation très schématique d'un mécanisme de lyse cellulaire par contact entre un LT cytotoxique et un macrophage infecté et libération de molécules perforantes (perforines) provoquant la mort de la cellule cible par nécrose en désorganisant la membrane cellulaire par un mécanisme dépendant du calcium. |
|||||
|
|
||||||
|
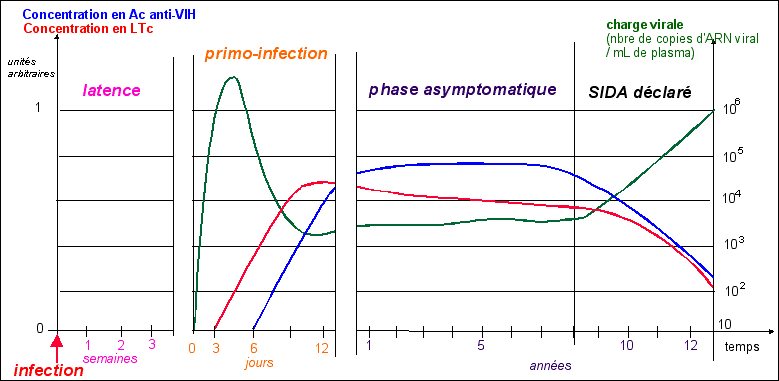
phase de latence |
La contamination par le VIH est toujours suivie par une phase de latence de quelques semaines. Elle cesse lorsque l'on voit apparaître dans le sang un pic d'antigènes p24 (et donc d'AC anti-p24; la p24 est une des protéines de la capside) associé à une augmentation brutale du nombre de globules blancs infectés. |
Il ne faut pas confondre phase de latence (ou quiescence) et phase asymptomatique (voir plus bas) qui ne sont pas au même niveau. Pendant la phase de latence, il n'y a pas moyen de détecter le virus sauf à le rechercher dans les cellules cibles (voir ci-dessous). Il n'y a pas d'Ac anti-gp24 dans le sang... |
La phase de latence peut
être plus longue et se faire dans les
macrophages ou les autres cellules
présentatrices d'Ag - qui servent alors de
réservoir
de virus- , tout comme dans les
lymphocytes T4. Dans ces deux cas le virus
latent peut se trouver dans une vésicule
d'endocytose ou bien rester dans le cytoplasme sous
forme d'ADN proviral circulaire, soit encore
s'insérer dans le génome de la
cellule hôte à n'importe quel endroit
grâce à l'intégrase que contient le
virion.
|
|||
|
détection du virus et séropositivité |
La détection du virus se
fait À TOUT MOMENT à partir de |
Après la phase de latence, et donc
après multiplication des virions, la détection
du virus se fait habituellement par la mesure de la
protéine p24 circulante (en fait la mesure
des Ac
anti-p24). On peut aussi
détecter le virus à partir du plasma. |
La recherche de séropositivité, c'est-à-dire de l'exposition au virus et donc de la production d'Ac anti-VIH (qui se trouvent dans le sérum d'où le nom de séropositivité, ce qui signifie que la recherche d'Ac dans le sérum est positive) se fait par des tests utilisant la technique ELISA sur différentes protéines du virus. Une confirmation est maintenant systématiquement apportée par plusieurs analyses western-blot des Ac dirigés contre les protéines de l'enveloppe et les protéines du gène gag (p7, p9 et p17). La séropositivité (séroconversion de négative à positive) se fait environ 3 à 12 semaines après l'infection. |
|||
|
guérison |
On peut légitimement se poser la question de savoir si un sujet, infecté par le VIH, est forcément séropositif. Cela dépend sans aucun doute de la sensibilité des tests utilisés et de sa propre production individuelle d'Ac. De même, on peut se demander si un sujet ne peut pas garder le virus à l'état quiescent sans qu'il ne se multiplie jamais. À la limite l'organisme peut-il éliminer le virus ? |
Les réponses à ces questions ne peuvent être absolument définitives, c'est une question de déontologie: on ne peut susciter de trop grands espoirs ou instaurer la méfiance envers les tests sans conséquences plus ou moins graves. Mais scientifiquement toutes les problématiques sont OUVERTES. Médicalement ou socialement c'est un autre problème. |
Il est clair que statistiquement
(et il ne s'agit pas
ici d'en débattre ni de proposer des explications
plus ou moins convaincues) |
|||
|
2.2.5 La phase locale se termine par la migration des phagocytes et lymphocytes vers les organes lymphoïdes périphériques |
||||||
|
La réaction locale va se poursuivre par une réaction généralisée initiée dans les organes lymphoïdes périphériques : rate et ganglions lymphatiques. C'est là que se déroule la majeure partie de la présentation des déterminants antigéniques par les CpAg. Si j'ai choisi de présenter dans la phase locale l'initiation de la réponse immunitaire spécifique que l'on qualifie aussi de réponse immunitaire acquise, il n'en reste pas moins que la phase généralisée va produire une réponse sans commune mesure avec cette phase locale. |
Les phagocytes présents sur les lieux de l'inflammation sont principalement des leucocytes (granulocytes neutrophiles notamment, voir cellules ci-dessus) qui ne vont pas jouer le rôle de CpAg. Par contre les monocytes/phagocytes infectés ou ayant phagocyté et lysé le VIH vont migrer vers les ganglions lymphatiques ou les organes lymphoïdes périphériques secondaires les plus proches. |
Les lymphocytes T et surtout les LB activés lors de la réaction inflammatoire vont aussi migrer vers les ganglions et participer à la phase généralisée. Enfin, on ne peut écarter l'hypothèse que des particules virales libres arrivent aussi dans ces organes lymphoïdes et activent directement la réponse immunitaire généralisée. |
||||
|
|
||||||
|
2.3.1 Les lymphocytes B activés se multiplient dans le cortex superficiel ganglionnaire |
||||||
|
Les LB activés prolifèrent dans le cortex superficiel (voir organes immunitaires ci-dessus) ganglionnaire. On les nomme alors lymphoblastes. |
Certains se différencient (irréversiblement) en plasmocytes sécréteurs d'Ac (mais ils perdent leurs mIg) et ont une durée de vie courte (quelques jours à quelques semaines tout au plus, selon le type d'Ig qu'ils sécrètent). Ils migrent vers la zone médullaire du ganglion lymphatique et vers les tissus. |
D'autres évoluent en lymphocytes B à mémoire de petite taille qui restent dans le cortex ganglionnaire. |
||||
|
2.3.2 Les plasmocytes sécrètent les Ac qui luttent contre la propagation du VIH et favorisent sa destruction |
||||||
|
Le mode d'action des Ac a déjà été vu dans la partie non spécifique : c'est la réponse à médiation humorale. |
Les Ac forment avec le VIH des complexes immuns empêchant sa pénétration dans les cellules cibles. et activant le complément qui favorise leur phagocytose. |
|||||
|
|
|
|||||
|
2.3.3 Les Ma infectés, au sein des ganglions, stimulent les LTh et les LTc qui se multiplient et vont lyser les cellules infectées |
||||||
|
On observe au sein des ganglions lymphatiques de nombreuses figures de contact entre les macrophages infectés et les LT. La présentation des déterminants antigéniques et la coactivation des LTh et LTc se passent donc aussi dans les organes lymphoïdes périphériques. La plupart des LT activés dans les ganglions se différencient en LT sécréteurs de cytokines (LT auxiliaires ou LThelper), certains en LT cytotoxiques (effecteurs). Ils se divisent activement. Les LT auxiliaires stimulent la phagocytose des complexes immuns et la division des autres LT activés. |
Les LT cytotoxiques peuvent lyser les macrophages ou d'autres cellules infectées (selon un processus décrit dans la partie précédente.: la réponse à médiation cellulaire). Les lymphocytes cytotoxiques impliqués ici comportent le plus souvent les marqueurs membranaires CD4+ et plus rarement CD8+ (voir plus haut les remarques à ce sujet : nous les désignons par leur fonction et non par leurs marqueurs membranaires). Enfin, les cellules cytotoxiques peuvent aussi être des polynucléaires neutrophiles ou des cellules NK. |
Remarque: |
||||
|
2.3.4 La multiplication du virus est initiée par l'activation des cellules cibles infectées |
||||||
|
...mais le VIH peut aussi se multiplier |
C'est la division des cellules cibles qui active la plupart du temps le provirus à l'état latent. C'est donc ici le paradoxe de ce virus qui touche les cellules immunitaires : c'est en voulant se défendre que l'organisme multiplie le virus. |
C'est cette phase de multiplication active du virus qui, la plupart du temps, est appelée phase de primo-infection. Elle dure environ deux semaines et est suivie par une phase asymptomatique. |
Pendant la phase de primo-infection des symptômes légers peuvent apparaître: fièvre, petites douleurs musculaires... |
|||
|
l'enveloppe virale est une membrane plasmique très modifiée prise à la cellule hôte |
L'activation du provirus inséré dans le génome de l'hôte se fait par des facteurs de transcription qui se fixent sur les zones LTR du provirus. Plusieurs ARNm sont alors produits en plusieurs exemplaires. Ils sont de petite taille (2 kb) et subissent différentes maturations (épissages) pour donner des peptides régulateurs qui vont stimuler la transcription-traduction des protéines-de-structure virales (gag, env, pol), ainsi que la transcription de l'ARN viral. |
On considère que l'assemblage est autocatalytique (s'autostimule) afin de former les particules virales (capsides). Les nouveaux virions sont produits par bourgeonnement à la surface de la membrane de l'hôte, chaque virion emportant un fragment de membrane dans lequel les protéines virales comme les gp120-gp41 se sont insérées. |
La cellule hôte est le plus souvent lysée mais on ne sait pas trop s'il faut en rendre responsable le fort bourgeonnement viral ou bien un mécanisme de destruction naturel (voir autonome, de type apoptose) du fait notamment des profondes modifications de la cellule hôte, particulièrement pour ce qui concerne la composition de sa membrane plasmique. |
|||
|
Du provirus au virion, une bonne occasion de réviser son cours de 1èreS sur la synthèse des protéines (ce qui est bien le but de ce schéma; en effet, de par sa simplification, il ne rend pas compte des modifications des différents systèmes de la cellule hôte dues à l'insertion du provirus). |
||||||
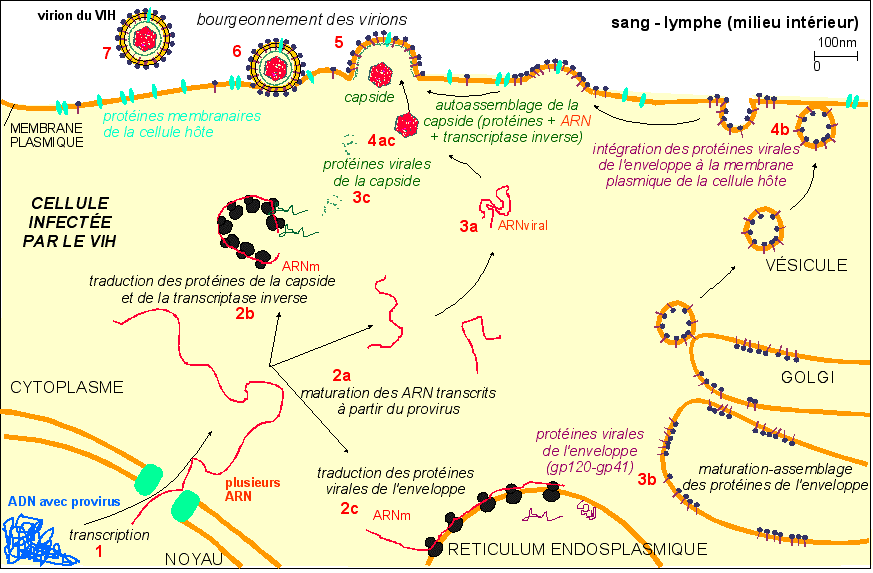 Petit
test de connaissances: où sont ajoutés
les sucres des glycoprotéines (gp) de l'enveloppe
gp120-gp41 ? |
||||||
|
les étapes de la maladie |
On pense que la phase asymptomatique est due à l'efficacité du système immunitaire, tant que le nombre de LT-CD4+ est suffisant. Après, les LTc notamment n'arrivent plus à juguler le développement viral et l'organisme est trop affaibli pour s'opposer à l'installation de maladies opportunistes qui conduisent inéluctablement à la mort du patient. Mais les mécanismes de la maladie sont loin d'être clarifiés de façon définitive. Lors de la phase de SIDA-déclaré, des symptômes apparaissent et sont connus sous le nom de complexe associé au SIDA ou ARC (AID related complex, en anglais). Ils associent augmentation du volume des ganglions, perte de poids, fièvre, sueurs, candidose buccale (muguet) et des formes graves d'infections herpétiques (voir ancien cours). L'ARC évolue en SIDA manifeste dans une proportion de cas déterminée. |
Le SIDA "maladie" (au niveau de l'organisme), est principalement expliqué par la baisse du nombre des LT4 même si de nombreux autres mécanismes sont évoqués (notamment la destruction des cellules dendritiques, la variabilité intrinsèque du VIH qui submerge le système immunitaire, l'induction de l'apoptose des cellules T par le VIH...). |
||||
|
|
||||||
|
Ce schéma simpliste cache de grandes incertitudes sur les populations de LT, car on sait que ces cellules forment une population qui ne se développe que chez le jeune (voir partie sur les organes immunitaires). Le thymus est nécessaire à la maturation des LT, mais le thymus s'atrophie et l'on peut dire qu'à 40 ans il n'y a plus guère que de la graisse. On a bien du mal à déterminer quelles sont les durées de vie des différentes populations de LT. Qu'en est-il au niveau cellulaire ? En quoi la vie d'une cellule infectée est-elle modifiée ? C'est ici que je voudrais justifier le
titre de cette partie: le SIDA, une maladie du
système génétique des cellules
immunitaires (du moins celles qui sont les cellules cibles).
|
||||||
|
une maladie du système génétique |
Plusieurs approches théoriques
sont sans aucun doute pertinentes. En voici deux :
|
* Le plus évident est donc d'abord
de considérer les effets du VIH sur les
caractéristiques génétiques de la
cellule infectée en tant que cellule du
système immunitaire. |
Mais ce n'est pas du tout cela qui est observé, la cellule infectée semble, avant d'être éventuellement détruite si le virus se multiplie en elle, être affectée de bien des manières, voir même détournée de sa fonction immunitaire. Il est bien difficile de rendre compte de ces modifications par une explication génétique à partir de l'ADN viral. |
|||
|
|
||||||
|
* La deuxième approche consiste
alors à considérer que ce sont justement les
effets du VIH sur les cellules cibles qui vont nous
permettre de comprendre davantage le rôle des
éléments génétiques, plus ou
moins étrangers, insérés dans la
cellule, mais aussi d'appréhender d'autres
mécanismes cellulaires qui ne résultent pas
directement de l'expression du génome viral. En fait
,les effets de la pénétration (ou
peut-être devrait-on dire de "la
capture")
d'un virus et de son activation - en vue d'une
multiplication - sont beaucoup plus vastes que le strict
imaginaire génétique ne le laisse l'entrevoir.
C'est tout le fonctionnement cellulaire qui est
affecté. |
On considère en effet que le VIH a un effet cytocide (destructeur de cellules) principalement par le fait de son action au niveau des membranes des cellules cibles. L'insertion de protéines virales peut entraîner la fusion de quelques dizaines de cellules en un syncitium (apellé polycaryocyte) qui est ensuite attaqué par le système immunitaire (ce cas fréquent pour les virus herpès ou le virus de la rougeole est aussi rapporté pour le VIH). Des cas très fréquents de fusion provisoire de cellules immunitaires infectées par le VIH ont été rapportés. Ils sont considérés comme des moyens de propagation du virus sans se découvrir face au système immunitaire de l'hôte. Dans le cas où l'on considère le virus comme une particule informative entre cellules cette fonction est encore plus intéressante : communiquer sans déclencher de réponse immunitaire. Le VIH peut aussi se transmettre directement de cellule à cellule par l'intermédiaire de filopodes établissant des connexions entre les cytoplasmes des cellules infectées. Ces filaments très fins - appelés nanotubes, car d'un diamètre de quelques dizaines de nanomètres- et plus ou moins rigidifiés (par des filaments squelettiques - voir leur rôle lors de la division cellulaire en 1èreS) peuvent atteindre une centaine de micromètres de long (abstract en anglais, revue avec photos en anglais). Mais l'on ne sait pas si le virus emprunte une voie externe (comme un radeau membranaire par exemple) ou interne (intracytoplasmique). On a juste la preuve que les filaments permettent une transmission rapide (moins d'une heure) in vitro dans une matrice artificielle permettant l'établissement des filopodes. |
D'autres altérations des fonctions cellulaires sont connues (inhibition de la transcription et de la traduction des gènes de l'hôte, dommages aux lysosomes, effet toxique direct du fait de la concentration cytoplasmique élevée des protéines virales, formation d'inclusions pouvant contenir des structures cellulaires comme les ribosomes ou même de la chromatine (pour les herpèsvirus), cassures chromosomiques, induction de la transformation de la cellule hôte en cellule maligne...). Toutes ces altérations n'ont cependant pas été rapportées dans des cas d'infection par le VIH. |
||||
|
|
||||||
|
Les chercheurs n'ont pas été sans remarquer que les séquences génétiques qui permettent au virus, d'une part de s'intégrer dans le génome hôte, et d'autre part d'être transcrit puis traduit, sont très similaires à des séquences de la cellule hôte. Du point de vue évolutif, inconsciemment tout au moins, on est porté à penser que le génome viral provient du génome eucaryote par modification. On serait donc en face d'un fragment de génome, capable de s'échanger entre cellules et même entre organismes pluricellulaires, de façon plus ou moins autonome. |
Remarques: On peut accéder à certains articles (en anglais) de Barbara Mac Clintock à l'adresse: http://profiles.nlm.nih.gov/LL/ (voir la section "Documents" de chaque page). - Le transfert latéral de gènes (LGT) est aussi à mettre en parallèle avec l'insertion de l'ADN viral (voir cours de première S). - On fera un judicieux rapprochement avec les travaux entrepris actuellement dans le cadre de la recherche sur les cellules souches induites (iPS, cellules souches pluripotentes induites). Une équipe japonaise a réussi à provoquer la multiplication de cellules différenciées de peau chez la souris et leur dédifférenciation (on parle de reprogrammation de façon un peu naïve) à partir de l'insertion de quelques gènes grâce à des vecteurs viraux (voir par exemple: http://www.genethique.org/ revues/revues/ 2008/fevrier/ 20080215.1.asp). Le rôle des séquences génétiques des virus dans la modification du fonctionnement cellulaire est une voie de recherche très ouverte. |
En travaux |
||||
|
|
||||||
|
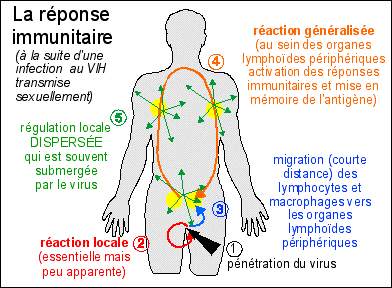
Si l'on reprend le schéma de synthèse de la réponse immunitaire, on peut le modifier pour essayer de rendre compte de la réponse à une infection au VIH |
||||||
|
|
1-2-3 - phase de réaction locale: infection, avec réponse immunitaire non spécifique (inflammation) puis migration des cellules immunitaires infectées et stimulées vers les organes lymphoïdes périphériques les plus proches du point d'entrée. Une particularité de l'infection au VIH est la présence d'une phase de latence d'au moins quelques semaines au sein des cellules infectées. Cette phase locale est APPAREMMENT peu visible et peu importante. Pour insister sur cet aspect, j'ai choisi de présenter, dans le cas d'une infection par le VIH, cette phase comme celle où se met en place la réponse immunitaire spécifique, même si cette dernière se développe surtout pendant la phase généralisée. 4 - phase de réaction généralisée avec mise en mémoire de l'Ag. Cette phase correspond d'abord à une multiplication des cellules immunitaires spécifiques au virus, mais aussi à une multiplication du virus lui-même (et donc à la phase de dispersion). Elle est nommée cliniquement "phase de primo-infection". Elle est suivie par une "phase asymptomatique" que l'on interprète comme due à la réaction immunitaire s'efforçant de détruire le virus, qui relève donc de la phase immunitaire suivante.. |
5 - phase de régulation locale dispersée. À l'inverse du mécanisme représenté lors d'une blessure, il n'y a pas à proprement parler de phase locale de régulation, car les réponses immunitaires de l'organisme à une infection par le VIH sont dispersées dans tous les tissus atteints, c'est-à-dire tous les tissus dans lesquels peuvent se trouver des cellules infectées. Comme ce sont principalement les LT4 et les monocytes/macrophages qui sont les réservoirs à virus, on peut donc les trouver dans tout l'organisme. Cette réponse locale dispersée est en quelque sorte simultanée avec la phase généralisée puisque c'est elle qui est à l'origine de la dispersion du virus. |
||||
|
|
||||||
 (photo extraite de Microbiologie,
De Boeck, très modifiée avec une très
faible résolution pour qu'elle ne puisse être
utilisée qu'à titre d'illustration de ce
cours)
(photo extraite de Microbiologie,
De Boeck, très modifiée avec une très
faible résolution pour qu'elle ne puisse être
utilisée qu'à titre d'illustration de ce
cours)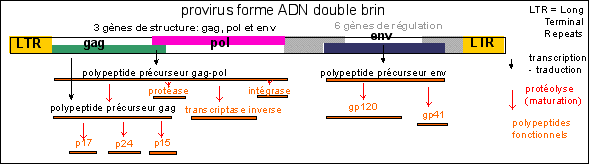
 Le
schématisme du virion est repris du schéma
précédent;
Le
schématisme du virion est repris du schéma
précédent;