retour plan du cours
de 1èreS, partie
précédente (A1),
panorama
Le symbole
![]() , utilisé pour la biologie
théorique,
marque les ouvertures théoriques dans une vision
Thomienne,
ou du moins qui se
croît thomienne.
, utilisé pour la biologie
théorique,
marque les ouvertures théoriques dans une vision
Thomienne,
ou du moins qui se
croît thomienne.
|
Plan
|
||||||
|
Compléments associés (hors de cette page) ; * Les
4 causes d'Aristote
en
sciences de la
vie
ces compléments cadrent avec le PROGRAMME DE 1ÈRES : * Le gène moléculaire, unité fonctionnelle synthétique |
En travaux |
|||||
|
|
||||||
|
2.1 Les protéines sont sans cesse synthétisées et dégradées par chaque cellule : elles sont la trace de l'activité synthétique des cellules |
le terme protéine est employé de façon abusive ici comme équivalent du terme polypeptide (voir remarque dans la page sur le gène) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La synthèse des protéines à partir des ARNm est traitée sur une page spéciale: le gène moléculaire, unité fonctionnelle synthétique |
Cette partie a pour but de s'efforcer de comprendre l'importance des protéines dans une cellule par rapport aux autres molécules comme les glucides ou les lipides ou encore les acides nucléiques. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les protéines forment environ 60% de la masse sèche de la cellule procaryote ou eucaryote (voir niveaux d'organisation du vivant). Mais cette masse relative par rapport aux autres composés (acides nucléiques, polysaccharides, lipides et enfin petits métabolites) peut être encore plus importante sur un organisme supérieur comme un vertébré qui possède des structures comme les phanères (poils, carapace, écailles, griffes, sabots, plumes...) entièrement composés de protéines. |
On distingue : |
Les protéines sont sans cesse renouvelées globalement. C'est-à-dire que la protéine est dégradée dans sa totalité et qu'une nouvelle protéine prend sa place. Lorsque ce sont des protéines membranaires , des portions entières de membrane sont dégradées (récupérées par la cellule par endocytose) puis (ou alors qu') une nouvelle membrane avec de nouvelles protéines vient se mettre en place (par exocytose). La dégradation des protéines se fait soit directement dans le cytoplasme par des enzymes (protéases), soit dans des sous-unités protéiques spécialisées de grande taille (protéasomes), soit encore dans des vésicules généralistes de dégradation (lyzosomes). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La taille des protéines est
limitée par leur mode de synthèse au niveau
des ribosomes. Les protéines les plus grosses
contiennent plusieurs milliers d'aa et sont
intracytoplasmiques. Pour les grosses
protéines extracellulaires, de petites
sous-unités sont sécrétées puis
assemblées à l'extérieur de la cellule
(collagène...).
|
un cours classique, bien dans le paradigme dominant et bien illustré (sur la synthèse et la dégradation des protéines): http://www.ulysse. u-bordeaux.fr/ atelier/ikramer/ biocell_ diffusion/gbb.cel.fa. 106.b3/content/ access.htm#D14 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Les protéines sont souvent impliquées dans des assemblages; soit avec des molécules comme les lipides, notamment au sein des membranes ; soit entre elles.
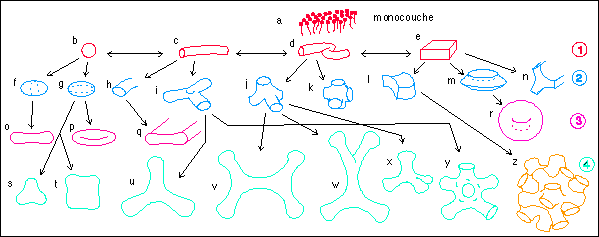 |
* Dans le premier cas l'incorporation des protéines à des surfaces peut être relié à la dynamique qui engendre les surfaces. Ce sont principalement des lieux d'affrontement entre deux dynamiques (bords). Ces surfaces ne sont bien sûr pas
des plans mais dessinent des boules, tores et autres
cylindres dont la topologie a été
présentée par Thom dans de nombreux ouvrages.
On peut aussi voir l'article d'Yves Bouligand à ce
sujet (sur l'ancienne
page sur les modèles; je
recommande particulièrement la figure
présentant Une
"microzoologie" des formes observées et
supposées de micelles "membranaires"
). |
* Dans le second cas, si on ne souhaite pas se limiter, comme pour les enzymes, à un assemblage autocatalytique et spatialement contrôlé, on peut par exemple s'intéresser à l'organisation du cytoplasme en clusters. Selon cette théorie, la plupart des protéines intracellulaires occuperaient des domaines cytoplasmiques (clusters) de 40 nm3 de volume pour un nombre de résidus compris entre 120 et 300 et un diamètre moyen de 3,5 nm (la taille des clusters est un des fondements de l'organisation de l'eau intracellulaire en microdomaines dans la théorie de Watterson (1982,1991), voir page sur la cellule, ou (en anglais) le site http://www.lsbu.ac.uk /water/ clusters.html et notamment l'article ENZYME FUNCTION: RANDOM EVENTS or COHERENT ACTION ?). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Pour ce qui est de la formulation des dynamiques, le travail de Thom, sur lequel je m'appuie, est souvent grevé par une conception "rhéologique" erronée de la cellule (voir page sur la cellule, pour une conception plus moderne). Comme je n'ai pas les compétences mathématiques pour proposer de nouveaux modèles, je suis parfois obligé de présenter le modèle thomien comme point de départ sans avoir quelque chose de plus parlant à montrer. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Deux types de protéines peuvent classiquement être envisagés: |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Sur le site de PDB on peut télécharger un MAGNIFIQUE poster éducatif (29,5 Mo) ftp://pdbx.org:10601/ education_discussion/ molecule_of_the_month/ poster_full.pdf qui prétend présenter les relations structure-fonctions, mais qui, en fait, illustre la relation forme - fonction locale |
* certaines protéines qu'on peut qualifier de structurales semblent former des assemblages souvent de grande taille dont les fonctions résultent des propriétés de l'assemblage: elles possèdent donc une fonction émergente de la réunion (et souvent de la répétition d'un grand nombre) de sous-unités protéiques. Des protéines briques... des protéines d'assemblages cellulaires... des protéines "légos" (voir une classification des protéines ci-dessous et les images du poster référencé ci-contre <-----). |
* d'autres protéines, que l'on peut qualifier de protéines outils (ou machines) dont les propriétés sont directement liées à leur forme, à la répartition de leurs charges, à leurs interactions avec le milieu ou avec une autre sous-unité, ou encore avec un ligand... |
Remarque: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La
compréhension des fonctions locales passe par les
relations entre la structure protéique (notamment au
niveau des domaines ou motifs qui composent les
protéines) et la fonction locale de chaque
protéine.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La classification actuelle des protéines se base essentiellement sur des domaines. |
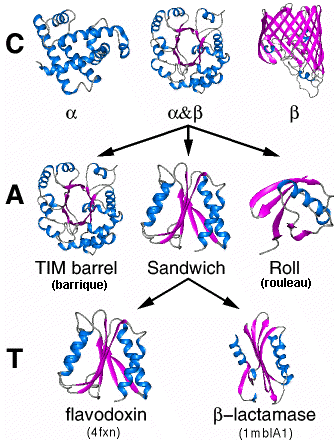 Quelques exemples de structures de domaines de certaines protéines (avec rendu ruban : hélices alpha en bleu et feuillets bêta en rose); les codes pour la flavodoxine et la bêta -lactamase correspondent aux fichiers pdb. |
Cinq niveaux sont considérés dans la CATH Protein Structure Classification
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Plusieurs méthodes spectroscopiques ont permis de modéliser les mouvements des groupements au sein des protéines pour essayer de comprendre leur fonction locale. |
Imaginer la protéine comme un solide dont certaines parties sont mobiles est une façon mécaniciste de comprendre la fonction locale des protéines. Mais elle n'est pas inutile. Il est juste prudent de se garder de penser que cela se passe ainsi dans le cytoplasme. |
Les sites en anglais sont formidablement
documentés .
En travaux |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
La question sous-jacente est de retrouver
un déterminisme expérimental auquel se
raccrocher. Si la forme de la protéine n'est pas
vraiment codée par sa séquence comment
peut-elle être déterminée pour
constituer une protéine particulière
synthétisée à tel moment par telle
cellule ? |
La meilleure analogie reste l'outil. Le matériau est composé de chaînes d'aa. Selon la séquence on peut avoir des éléments denses, souples, flexibles, empilables....Certains se suffisent à eux mêmes et ne donnent pas d'assemblages macromoléculaires (notamment certains enzymes, hormones, anticorps...). D'autres forment des structures ou participent à des structures complexes : cytosquelette, fuseau de division, myofilaments, fibres de liaison, fibres et plans (kératine...)... L'idée de fond de cette page consiste à dire que c'est la cellule elle-même qui induit, par ses dynamiques, la synthèse et l'utilisation de telle ou telle protéine. Un changement de dynamique, pouvant provenir de l'extérieur, conduit la cellule à réorienter ses synthèses. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Comment faire le lien entre les fonctions globales (de la vie) et les fonctions locales des protéines ? Cette question est loin d'être résolue. Et pourtant des éclaircies théoriques ont été faites et méritent d'être diffusées largement. Si vous ne l'avez pas lue je renvoie d'abord à la citation de René Thom dans la page précédente. |
L'idée de base serait que la forme métabolique de la cellule (définie dans un espace de grande dimension) générerait la forme métabolique des molécules (c'est-à-dire non seulement leur forme spatiale mais aussi les conditions de leur synthèse et de leur dégradation). Avec les mots de Thom: «Le point important est de préciser les contraintes qui relient ce comportement biochimique global à la morphologie spatio-temporelle...». René Thom avait déjà noté combien il était surprenant que les caractéristiques des molécules que le biochimiste voudrait voir agissantes dans la cellule sont justement les caractéristiques globales de la cellule ou du tissu que l'on cherche à expliquer ; c'est ce qu'il appelle le caractère platonicien des fonctions biologiques (L'explication des formes spatiales : réductionnisme ou platonisme ?, 1980f4.pdf). |
Le chapitre suivant se propose de donner des exemples pour illustrer ces propos. Bien évidemment je ne fournis pas les réponses (je ne m'aventure pas à donner des formes métaboliques) mais je m'efforce de montrer le champ des recherches actuelles qui vont dans cette direction. Je n'oublie pas les objectifs du programme de cette partie : du génotype au phénotype. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Un dossier CNRS-Sagascience Chimie et beauté sur la peau : http://www.cnrs.fr /cw/dossiers/ doschim/decouv/ peau/index.html |
2.3 Comment est réalisée la synthèse des protéines dans les cellules de la peau humaine ? Nous prendrons l'exemple de la peau, comme tissu complexe, où nous choisirons quelques protéines qui y sont synthétisées: (1) collagènes, (2) kératines et (3) protéines associées à la synthèse et au stockage des mélanines. Le but est de montrer quelques protéines, en tant que molécules - étudiées au niveau biochimique - mais replacées dans leur contexte cytologique (de cyto=cellule) et histologique (d'histo = tissu). Il s'agit d'essayer de retrouver les dynamiques cellulaires auxquelles elles sont associées. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Introduction (in E.U. "peau") |
* embryologie
expérimentale |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
source principale E.U. article "Collagène" dossier CNRS-Sagascience : http://www.cnrs.fr /cw/dossiers/ doschim/decouv /peau/colla.html |
2.2.1
Les
collagènes
sont des protéines fibrillaires extracellulaires
d'adhésion
sécrétées par les fibroblastes et
d'autres cellules
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les collagènes sont des glycoprotéines. |
Il existe de nombreuses variétés de collagènes mais toutes sont assemblées à partir de chaînes protéiques allongées (le procollagène) longues d'environ 1400 aa et possédant deux têtes globuleuses au niveau des extrémités C-terminale et N-terminale. Il existe plusieurs dizaines de séquences possibles pour ces molécules mais des gènes différents associés à chaque molécule n'ont pas été identifiés (même s'ils sont suspectés). Certains acides aminés comme la Proline sont modifiés dès leur accrochage dans la chaîne de procollagène. Des sucres, sont aussi ajoutés à certains acides aminés alors que la chaîne en formation est encore dans le cytoplasme. |
Les molécules de procollagène passées dans le REG s'assemblent ensuite en triple hélice alpha (par des liaisons faibles que l'on peut dissocier par chauffage modéré à 37°C... ce que l'on fait dans la gélatine qui est composée de molécules partielles de collagène récupérées à partir d'os ou de cartilages) au niveau de leur partie droite pour former des molécules allongées d'environ 300 nm x 16 nm (si l'on supprime les têtes globulaires, qui sont d'ailleurs coupées la plupart du temps juste au moment de la sécrétion), nommées tropocollagène. Ces molécules sont sécrétées par les cellules conjonctives ou fibroblastes et participent (avec l'élastine par exemple...) à la formation de la matrice extracellulaire qui maintient de nombreux tissus chez les animaux (des collagènes sont connus aussi bien chez les éponges que chez l'ensemble des vertébrés). |
Dans de nombreux cas les molécules de tropocollagène s'organisent ensuite en fibrilles de plusieurs (5?) molécules alignées et légèrement décalées entre chaque file de molécules et formant ainsi des motifs répétitifs visibles en microscopie optique. Les molécules de tropocollagène y sont modifiées par des liaisons chimiques fortes. Ces fibrilles s'assembleraient pour donner des fibres de diamètre variable (quelques micromètres à quelques centaines de micromètres). Une partie non négligeable des molécules de tropocollagène sécrétées est détruite immédiatement sans que l'on en connaisse la raison. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Page pédagogique -en anglais- sur le site pdb (puis "Exploring the structure" en bas de page) |
Pour des
illustrations: |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On ne connaît pas de fichier PDB d'une molécule de procollagène naturelle. |
Seuls quelques exemples de petits peptides de synthèse sont proposée sur la base SCOP http://scop.berkeley.edu/ data/scop.b.bb.f.A.A.html (choisir collagen-like peptides (fold 5) dans la section designed proteins). |
Le plus proche d'une molécule de tropocollagène sans ses extrémités globuleuses est le fichier 1BKV.pdb (le fichier contient 3 chaînes de 30 aa alors que l'on pense que chaque chaîne contient atteint 1400 aa et possède une tête globuleuse). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les cellules capables de synthétiser des collagènes sont non seulement les fibroblastes du tissu conjonctif mais aussi les cellules cartilagineuses, les cellules osseuses, les cellules musculaires... |
Il existe de très nombreuses pathologies de la synthèse des collagènes, aussi bien chez l'embryon que chez le jeune ou encore l'adulte et le senior (la synthèse de collagène ne diminue pas avec l'âge (et augmente même souvent ce qui conduit à des fibroses) mais le type de collagène synthétisé change souvent et conduit à des pathologies comme celles de ligaments insuffisamment élastiques ou de vaisseaux dont la lame basale est épaissie mais fragilisée)... En médecine légale, l'âge approximatif d'individus décédés. peut être déterminé à partir du tendon du diaphragme par l'étude de sa résistance à la digestion par la collagénase ou à sa résistance à la contraction thermique. |
D'une façon biomimétique
fonctionnelle les collagènes permettent aux
industriels de fabriquer des gélatines qui sont les
composants majeurs des colles
(que l'on retrouve dans le nom
"collagène"). La lutte contre les rides du visage qui apparaissent avec l'âge est curieusement basée sur l'argument que les cellules du derme sécrètent moins de collagène avec l'âge, ce à quoi on vous propose de remédier par des injections sous-cutanées de collagène. Il s'agit davantage de modelage à partir d'un matériau réputé inoffensif que d'une compensation (l'injection de collagènes bovins ou porcins en est l'indice), même si l'ajout de certaines enzymes permet l'établissement de ponts entre les fibres nouvelles et le réseau en place. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Deux paramètres principaux semblent gouverner la synthèse des collagènes (en plus des éléments génétiques) : l'âge des cellules (selon les types cellulaires ce sont des cellules jeunes ou âgées qui sécrètent le plus de collagène) et leur état de tension (les cellules soumises à des tensions sécrètent davantage de collagène). Chez l'embryon, ce sont les cellules mésenchymateuses (cellules non différenciées du mésoderme), du derme et secondairement de l'hypoderme, qui, dès le 2ème mois, sécrètent la matrice de collagène, à laquelle viennent s'ajouter les fibres élastiques vers le 5ème mois. |
Les fibres de collagène sont
considérées physiquement comme des
fibres viscoélastiques dont la
déformation à l'étirement est d'abord
élastique (rapide et qui revient à son
point de départ lorsque cesse la contrainte) mais
aussi visqueuse dans la mesure ou la
déformation augmente lentement avec une
rémanence, ce qui induit que la fibre se
déforme plus lentement et avec une moindre amplitude
que si elle était seulement élastique. |
Les fibres de collagène sont résistantes avant tout à la tension. Elles sont sécrétées par des cellules soumises à des tensions et sont davantage sécrétées lorsque ces cellules sont soumises à des tensions supplémentaires.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
article d'Yves BOULIGAND: CRISTAUX LIQUIDES - Phases mésomorphes biologiques (E.U.) |
Pour une image présentant un biomatériel (synthétique) : 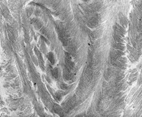 une phase cristalline liquide de collagène stabilisée : on remarquera la structure en arceaux caractéristique des phases cholestériques (que l'on retrouve avec la cellulose par exemple), pages de l'équipe "matériaux du vivant" de l'UMPC et particulièrement "Biomatériaux et hybrides organo-minéraux" (ancienne page 2007) |
Ecole polytechnique; Mathématiques appliquées au vivant; http://www.cmap.p olytechnique.fr/ spip.php? rubrique23
Le groupe de travail Mathématiques-Biologie de l'ENS : http://www.dma.ens.fr/ equipes/edp/biomath/ biomath.html
Département de mathématiques appliquées de l'ENS : http://www. dma.ens.fr/ CNRS-INPG-Unive Grenoble-EPHE Université de Bordeaux - Centre de
recherche Blaise Pascal: |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
« En résumé, notre méthode appelée OFSHM (Orientation Field-Second Harmonic Microscopy : Microscopie d'orientation de champ par les harmoniques secondes (?)...) fournit donc une technique non destructive et potentiellement non invasive permettant de réaliser des images profondes de structures fibrillaires non linéaires (collagène, mysosine), et ainsi apprécier l'organisation structurale normale de tissus sains ou malades. OF-SHM peut s'utiliser jusqu'à quelques centaines de micromètres de profondeur et ne nécessite pas de métallisation puisqu'elle utilise un signal endogène.» |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Des pages intéressantes par leur
démarche pédagogique (ne sont plus accessibles
en 01/2010, dommage) : http://www.ac-versailles.fr/
etabliss/ lyc-lecorbusier-poissy/ SVT/TP_1S/ Cheveu/
cheveux_G.htm; plusieurs TP sont proposés autour des
cheveux et permettent de balayer cette partie du programme :
une approche biologique intelligente.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
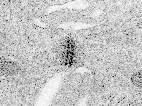 Desmosome MET (environ x 50.000): on distingue très bien sur les côtés gauche et droit de la photo les filaments de kératine dans le cytoplasme. Les membranes des deux cellules réunies ici séparent la photo approximativement selon un axe médian vertical. (accès à l'image à partir de la page: http://www.udel.edu/biology/ Wags/histopage/ empage/eep/eep.htm) avec l'aimable autorisation de Dr. Roger C. Wagner - Professor Emeritus of Biological Science - University of Delaware schéma d'interprétation d'un desmosomes sur biodidac : http://biodidac.bio.uottawa. ca/ftp/ BIODIDAC /Zoo/ Cell/diagbw/ cell023b.gif un schéma de situation, une interprétation et une électronographie de desmosome sur le site de Biologie du développement (légendes en anglais) : http://8e.devbio.com / image.php?id=104 |
Les kératines font partie des
cytofilaments, c'est-à-dire des
filaments (type intermédiaire,
apolaires et de diamètre compris entre 10 et 15 nm)
qui constituent le
cytosquelette des cellules
(qui comprennent aussi, d'autre part, les
microtubules (25 nm de diamètre) et les
filaments fins d'actine (5 à 9 nm de
diamètre)).
|
Les kératines sont
caractérisées par leur insolubilité
dans l'eau (liée à leur absence de
polarité) et leur résistance aux enzymes
protéolytiques (enzymes dégradant les
protéines par rupture des liaisons peptidiques).
Pour les séquences |
On connaît actuellement plus de 49 gènes fonctionnels codant pour des molécules filamenteuses de kératine, qui peuvent être différentes, et qui s'associent entre elles en formant des dimères (qui sont les unités de base: deux molécules s'associent parallèlement c'est-à-dire avec leurs extrémités NH2 du même côté) puis des tétramères par association antiparallèle (tête-bêche) de deux dimères. Les polymères d'ordre supérieur donnent des fibres de diamètre variable. 5% des kératines du cytoplasme des cellules épithéliales sont sous forme tétramèrique. Il existe des kératines "molles" et "dures" qui diffèrent par les molécules des dimères. Les domaines alpha-hélicoïdaux (environ 310 aa) sont très conservés (les séquences protéiques ne changent que très peu: elles sont composées majoritairement de répétitions de 7 aa ou heptades qui favorisent le superenroulement) alors que les parties terminales et les parties reliant les domaines alpha sont beaucoup plus variables et donc différencient les filaments intermédiaires entre eux (qui peuvent avoir des PM de 40.000 à 200.000 daltons). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
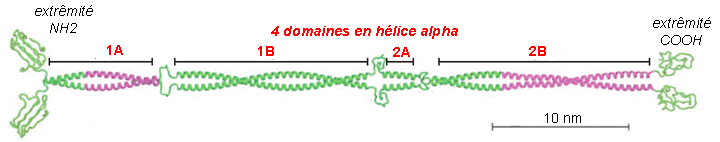 Ci-dessus : structure d'un dimère de base d'un filament intermédiaire Image à l'adresse http://www.theses.ulaval.ca/2004/22343/22343001.jpg légèrement modifiée Ci-dessous : assemblage bout-à-bout des dimères dans une fibrille puis des fibrilles accolées en un filament
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Ultrastructure PARTIELLE de
l'épiderme La synthèse de kératine est d'abord réalisée au niveau des kératocytes de la couche basale (couche de Malpighi) et de la couche suivante, non signalée ici, ou couche épineuse (stratum spinosum). Dans la couche granuleuse (stratum granulosum) les filaments de kératine (tonofilaments) s'agglomèrent par des ponts et forment des granules. La kératine "mûre" qui remplace tout le contenu cytoplasmique des cornéocytes est formée par l'agglomération des granules.
Pour de bonnes
électronographies des différents types
cellulaires voir par exemple le site
de l'Université de Mainz en Allemagne
: |
Toutes les cellules
épithéliales expriment des gènes
de kératine mais les cellules qui sont soumises
à des contraintes mécaniques (notamment les
épithéliums) possèdent un grand nombre
de filaments de kératine. Les
kératinocytes accumulent différents
types de kératine. Lorsqu'ils se transforment en
cornéocytes, qui sont des cellules
mortes, ils sécrètent un ciment lipidique
hydrophobe (riche en
céramides) qui les colle aux
cornéocytes voisins. La
différenciation des kératinocytes commence
avec la synthèse de protéines
particulières (involucrine et
transglutaminase par exemple) et la transformation de
la kératine en kératohyaline (filaments
de kératine réunis par des ponts grâce
à une protéine basique : la filagrine).
On pense que l'arrêt de la synthèse des
protéines est marqué par la formation d'amas
de ribosomes. La différenciation se poursuit par des
modifications de la kératine (nouveaux ponts
disulfure, interaction avec des protéines
matricielles, changement de taille moléculaire), et
la dégradation du noyau par un mécanisme
voisin de l'apoptose. Cependant il faut noter combien l'étude des filaments de kératine est difficile car elle est limitée à des expériences et observations in vivo (au niveau cellulaire, sur des souches isolées et souvent particulières). De nombreuses expériences sont aussi réalisées sur des "modèles" animaux (Souris...) chez qui on étudie les conséquences de certaines mutations affectant tel ou tel gène moléculaire de telle ou telle kératine (voir aussi référence ci-contre). |
La présence des kératines
et les jonctions étroites entre les cellules de
l'épiderme sont considérées comme
responsables des propriétés
protectrices de l'épiderme (surtout par la couche
cornée). Les kératines et le ciment
interstitiel lipidique sont hydrophobes, ce qui justifie
l'imperméabilité de la couche cornée
(et donc la difficulté d'y faire
pénétrer des cosmétiques en suspension
aqueuse).
La desquamation est initiée par des enzymes contenues dans le ciment hydrophobe interstitiel. La souplesse de la couche cornée dépend de la concentration en eau associée aux résidus protéiques cytoplasmiques hydrophiles. Lorsqu'ils sont en faible quantité la couche cornée devient cassante. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Le cytosquelette est une structure
dynamique :
Dans la différenciation des kératinocytes en cornéocytes la synthèse des kératines devient prédominante puis, brusquement, par un phénomène voisin de l'apoptose, il y a différenciation en cornéocyte avec formation d'une couche cornée. Cette différenciation coïncide avec l'exposition à l'air des kératinocytes (et donc avec leur dessèchement). Ces couches épidermiques les plus externes sont aussi celles où les tensions sont maximales. Des zones plus localisées comme les durillons (doigts), les cals au niveau de la plante des pieds... apparaissant plus tardivement, sous l'action de forces répétées, sont aussi de bons marqueurs de ce remaniement cellulaire mécanosensible. |
extrait de René Thom, La notion de préprogramme en biologie, 1984(f5), p11 «Le point important est de
préciser les contraintes qui relient ce comportement
biochimique global à la morphologie spatio-temporelle
décrivant l'évolution de la cellule au cours
d'un cycle de reproduction. Un couplage spatial entre phases
et régimes métaboliques va s'imposer. Le
complexe macromoléculaire doit nécessairement
coloniser la membrane limitante (relativement fixe) ; ainsi
va se constituer un cytosquelette, partiellement mobile,
mais qui néanmoins permet de suivre, dans une carte
globale définie dans R4, la trajectoire de
tout point lié à ce squelette
(mathématiquement le cytosquelette définit une
connexion). La partie du cytosquelette située dans la
membrane limitante est l'homologue des rives de notre flux
métaphorique, car la biochimie « statique
», de cette enveloppe varie peu (elle s'accroît
par polymérisation); au contraire les
macromolécules internes vont constituer la partie
mobile, la roue du moulin ; l'axe de la roue aura pour
homologue le
génome...»
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La dynamique de synthèse des kératines passe donc d'un régime cellulaire global (pour tout le cytoplasme) dans la phase embryonnaire, à un régime beaucoup plus localisé aux zones de tension et d'accrochage entre les cellules (au niveau de nœuds que sont les desmosomes) pour finir, lors de la différenciation en cornéocytes, par atteindre un régime paroxysmal conduisant à la mort cellulaire. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
En travaux |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Document de l'APBG-INSERM:
La peau humaine (1997) Un dossier CNRS-Sagascience :http://www.cnrs.fr/ cw/dossiers/ doschim/ decouv/peau /melanines.html |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Pourquoi
synthétiser des pigments? |
On aimerait pouvoir dire que les mécanismes conduisant à la synthèse et à l'accumulation des pigments colorant les cellules de la peau forment un groupe cohérent et homogène. Bref, on recherche un déterminisme qui serait associé à une fonction locale unique. Mais ... |
* du point de vue chimique seules les eumélanines forment un groupe de composés homogènes. Dans la plupart des cellules pigmentées, aussi bien chez l'homme que chez de nombreux animaux, la pigmentation résulte de l'accumulation de plusieurs pigments. De plus, des facteurs difficilement quantifiables, comme la vascularisation, interviennent aussi dans la coloration. |
* du point de vue cytologique on observe bien une certaine unité: des cellules fabriquent des grains colorés et les transmettent à d'autres cellules qui les stockent. Il y a donc séparation des mécanismes de synthèse et de stockage. D'autre part les mélanocytes ont une origine ectodermique particulière (crêtes neurales, voir ci-dessus), ce qui, avec leur morphologie (un corps cellulaire prolongé par de nombreux dendrites) et leur anatomie (un mélanocyte est en contact dendritique avec un nombre relativement précis de kératocytes (jusqu'à 36), souligne encore les affinités avec les cellules nerveuses. D'une façon générale, il est admis que les cellules nerveuses ont un rôle principal dans la communication (traitement des signaux sensoriels, motilité, contrôle rapide des fonctions organiques...voir suite cours de 1ère S). Ce rôle serait ici conforté. On peut ainsi affirmer que les mélanocytes ont des affinités (embryologique, structurale et fonctionnelle) avec les astrocytes. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Vidéo (.mov) de mélanosomes en mouvement à l'intérieur des mélanocytes séquence #1 (http://dir.nhlbi.nih.gov/ labs/lcb/mcb/images/1.mov sur le site http://dir.nhlbi.nih.gov/ labs/lcb/mcb/) |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Peut-on trouver un rôle à ces pigments ? |
Le premier rôle supposé est celui de la protection contre certains rayonnements solaires On a ensuite souvent avancé l'idée que ces pigments sont des déchets cellulaires; le stockage dans des cellules à courte durée de vie et leur élimination par desquamation serait un mode commode d'excrétion. |
Ne peut-on pas envisager que certains pigments soient synthétisés pour eux-mêmes ? Le déterminisme n'est pas alors dans la composition chimique des pigments, ni dans leur devenir, mais dans la couleur de peau elle-même. La couleur de peau comme lien social. Comment prendre en compte la dimension de relation de la couleur de peau qui intervient dans la structuration des sociétés ? |
Comment rendre compte de cette unité et de cette variabilité par un modèle ? En tout cas il est clair que l'on ne pourra se limiter au seul niveau moléculaire.
En travaux |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les mélanines
forment un groupe hétérogène dont
l'unité vient de leur rôle dans la coloration
des cellules.
|
1 - phæomélanines (ou
phéomélanines, jaune à rouge-brun
clair, solubles dans la soude) et eumélanines
(brun à noir, insolubles), mélanines
animales: par exemple les pigments des cheveux, des
plumes et de l'encre des Céphalopodes
(sépiomélanines) qui sont des
eumélanines; ils peuvent en outre (dans les plumes)
participer à des phénomènes de
diffraction de la lumière donnant ainsi des couleurs
irisées. Les pigments de cheveux humains roux et des
poils de renards rouges sont des phæomélanines.
Les phæomélanines et eumélanines peuvent
coexister ou s'ajouter à d'autres pigments et l'on
obtient ainsi une grande variété de
pigmentations (dans les plumes par exemple). |
2 - allomélanines
(très diverses), que l'on trouve dans les autres
royaumes que le règne animal par exemple la
sclérotine des cuticules d'Insectes, ou le pigment
noir des spores de champignons comme Aspergillus
niger. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Les mélanosomes possèdent une structure lamellaire revélée en microscopie électronique sur les jeunes mélanosomes. Dès que l'accumulation de mélanines est importante la structure lamellaire n'est plus reconnue (in Ultrastructure cellulaire et tissulaire, Cross, Mercier, 1995, De Boeck Université, p 248-249). |
Pour une vision limitée au paradigme moléculaire voir La couleur de la peau : une variable continue, Pascal Léonardi, Pour la Science, 313, nov 2003, pp 62-69 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Les couleurs de peau sont un paramètre continu (et qualitatif) dans l'espèce humaine |
La seule différence entre la peau
"noire "et la peau "blanche" réside dans le
nombre, la taille et le type des mélanosomes
(La peau
humaine, APBG-INSERM, doc A - fig. 3 et
4).. (voir
image
ci-dessus pour la position
de ces cellules en coupe
histologique)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Chez un homme à peau claire ( de type caucasien) les mélanocytes sont facilement reconnaissables: peu nombreux, à la base de l'épiderme, et au cytoplasme clair (ils sont peu actifs); les kératinocytes de la base (en contact avec les prolongements dendritiques des mélanocytes) ont souvent un cytoplasme plus foncé. Les mélanosomes sont injectés par petits groupes dans les kératinocytes et digérés rapidement lorsque que le kératinocyte migre vers la couche cornée.
|
Chez un homme à peau sombre (de type négroïde), les mélanocytes sont très difficilement différenciables des kératinocytes : ils sont très nombreux mais leur cytoplasme est sombre, tout comme celui des kératinocytes; on peut cependant les différencier sur de fines coupes à des grossissements plus élevés (x 600) par leurs expansions dendritiques et leur cytoplasme de couleur plus homogène que celui des kératinocytes. Les mélanosomes sont plus gros que ceux de la peau claire, injectés un à un dans les kératinocytes, et résistant, du fait de leur taille, à la digestion, de sorte qu'ils restent présents dans la couche cornée. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
La vascularisation dermique intervient bien sûr aussi dans la couleur de la peau (du fait de la couleur rouge sanguine, liée à l'hémoglobine) mais moins que la composition et la forme des mélanines stockées. |
Les mélanocytes se dispersent dans les premières couches (basales) de l'épiderme, au voisinage de la couche dite de Malpighi qui, par division, régénère l'épiderme de façon continue (on change d'épiderme tous les 6 semaines environ !). Le nombre de mélanocytes par rapport au nombre de cellules basales de l'épithélium varie selon les régions du corps entre 1/5 et 1/10; la face et les organes génitaux contenant le plus de mélanocytes par rapport aux cellules épithélilales basales. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
À la recherche d'un modèle continu Y-a-t-il un bord net entre les différentes couleurs à partir du moment où elles sont sur un substrat ? Ne peut-on pas passer continûment d'une couleur à une autre ? Pour René Thom, à la suite d'Aristote et avec Gœthe, la couleur et un genre (genos) et "bleu "ou "rouge" sont des espèces (eidos). Avec le vocabulaire thomien on parle de prégnance et saillance. |
« Il faut ajouter qu'en
réfléchissant à ce qu'Aristote
appelait, l'équivalence par excès ou par
défaut entre deux organismes, d'Arcy Thompson a
été amené à l'interpréter
comme une isotopie entre les deux stratifications en
homéomères de ces organismes.
Découverte fondamentale, qui jette une lumière
sur la définition de l'espèce chez Aristote.
(Il s'agit plutôt d'une équivalence selon le
genre ( |
René Thom, inédit, Document 9 (16 novembre 1993) La Naturphilosophie, son apport historique, et quelques illustrations actuelles, 1993 (i), p64 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
 |
Il s'agit donc d'élaborer un modèle mathématique thomien qui utilise un paramètre social... En travaux... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
la partie sur l'ADN placée ici a été déplacée dans la page "Comprendre les génomes" |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Comment formaliser la
spécificité d'une cellule ? Le
paysage
épigénétique de Waddington
était une vision très intéressante,
continuiste, qui se différenciait de l'approche
cybernétique qui, quant à elle, a
débouché sur la science des réseaux que
l'on retrouve dans la biologie intégrative ou
systémique. Étant donné le sens
donné maintenant à
épigénétique, je préfère
parler de paysage phénotypique
mais c'est le sens de paysage
épigénétique de Waddington que je
cherche à
atteindre.
|
||||||
|
3.1. Comment une molécule participe-t-elle au paysage phénotypique ? ... ou quel est le sens d'une molécule vis-à-vis des caractéristiques d'un organisme ?
voir Introduction de ce chapitre |
... par sa
fonction locale
|
Une illustration d'un paysage énergétique du repliement d'une protéine (Fig 1 de l'article); celui-ci est en deux dimensions. Vous le rapprocherez aisément du paysage phénotypique de Waddington en 3 dimensions (voir cours de seconde sur l'effort pour la première approche sur les fonctions). |
||||
|
|
||||||
|
+ la méthode
d'investigation détermine le sens des
résultats
Par exemple : l'hémoglobine, synthétisée une fois pour toutes dans une hématie qui se meurt, transporte le dioxygène et de dioxyde de carbone (fonction locale) des organes respiratoires aux autres organes (fonction locale étendue). De par ses propriétés mécaniques, l'organisation de l'hémoglobine dans l'hématie est aussi responsable des propriétés élastiques de l'hématie qui permettent de comprendre sa déformation lors du passage de capillaires étroits et sa participation aux caractéristiques rhéologiques du sang.
voir page sur la science (l'enquête scientifique)
|
* La fonction locale peut être
déduite des propriétés
physico-chimiques. La fonction locale in
vivo est raisonnablement supposée
être une prolongation de la fonction locale in vitro.
Mais il est légitime de penser qu'elle ne s'y
résume pas.
|
Les erreurs viennent ; Il peut y avoir d'autres causes, pas forcément liées; pour établir une relation de causalité il faut explorer tous les cas possibles de présence de la fonction et d'éventuelle absence de la substance... et l'on obtiendra jamais de preuve. Enfin, et ce dernier point est lié au précédent, la technique de sélection empêche de conclure à un déterminisme : il suffit d'imaginer un autre mécanisme en compétition pour la même fonction locale étendue. Si l'on sélectionne des individus chez lesquels il n'y a pas de fonction locale on sélectionne aussi ceux chez qui le réseau ne compense pas la fonction; ce sont ceux qui ont toujours la fonction qu'il faut explorer et voir comment la fonction est réalisée... ce qui n'est guère possible car on est revenu au point de départ puisqu'il s'agit de trouver des causes... |
||||
|
- si possible, on SÉLECTIONNE un
"mutant"
qui ne synthétise pas cette substance et qui survit
; |
||||||
|
|
||||||
|
... je suis bien conscient que cette présentation reste beaucoup trop théorique ; je travaille à une formulation thomienne des exemples ci-contre... |
1er exemple: les cadhérines et l'adhérence cellulaire source: Biologie du
développement, Gilbert, de boeck, 2004, pp 74s |
Les cadhérines sont des
protéines intervenant en présence de CAlcium
dans l'ADHÉRence cellulaire. Ces protéines
intrinsèques (traversant la membrane) permettent
l'adhésion cellulaire grâce à la liaison
entre cadhérines (liaison
homophile entre cadéhenines du même groupe)
de deux cellules voisines , et, du
côté intracellulaire, s'ancrent au
cytosquelette d'actine grâce à des peptides du
complexe des caténines. |
Les cadhérines peuvent donc être considérées comme un groupe de protéines-crochet, ancrées sur le cytosquelette. De par leur fonction locale d'accrochage homophile (lorsqu'elles sont du même groupe), elles pourraient aussi assurer l'accrochage des cellules entre elles au sein d'un tissu. Des expériences in vitro et in vivo ont été tentés pour essayer de documenter cette fonction étendue. L'injection d'ARN antisens (qui bloquent les ARN des cadhérines et diminuent la cohérence des tissus) ou au contraire d'ARN supplémentaires de cadhérines (qui prolongent les adhésions), ont montré, localement, sur quelques embryons de Xénope, que les cahérines sont essentielles à la formation des structures embryonnaires. en travaux |
|||
|
|
||||||
|
2ème exemple: les hémoglobines et leurs propriétés ancien cours de terminale spécialité (voir données sur les hémoglobines: 2.2) |
La drépanocytose une
maladie associée à la présence en
proportion importante chez l'enfant puis chez l'adulte
d'hémoglobine anormale avec une ou deux des
chaînes ß (bêta) de l'hémoglobine
modifiées (forme S : substitution de la valine (Val)
à la place de l'acide glutamique (Glu) en
sixième position de la chaîne). |
Les propriétés locales de l'hémoglobine sont donc d'abord la fixation des gaz mais aussi la capacité à ne pas former des amas trop stables dans l'hématie qui empêcheraient la déformation souple des hématies nécessaire à leur circulation. La première propriété locale a été explorée notamment par les travaux inoubliables de M. Perutz (prix Nobel de chimie en 1962). La fixation autocatalytique du dioxygène sur les chaînes fut aussi une grande avancée de la biochimie appliquée à la physiologie humaine (voir par exemple http://www.ednes. com/gds/ po3.htm) . Enfin, la seconde propriété n'a été reconnue que bien tardivement. Elle n'est pas déductible directement de l'analyse de l'assemblage moléculaire que constitue une molécule d'Hb, déjà fort complexe. La fonction globale (qui est la nutrition) est inaccessible par voie montante depuis la molécule vers l'organisme. en travaux |
||||
|
|
||||||
|
3.2. On peut définir un paysage phénotypique cellulaire pour un unicellulaire |
Les paysages dynamiques doivent
être présentés dans des espaces de
très grande dimensions (accessibles à la
représentation par des "coupes" à deux ou
trois dimensions).
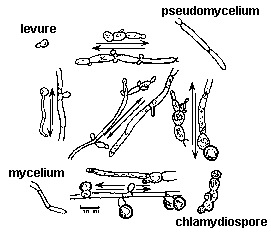 article (en anglais) : http://pharmaweb. univ-lille2.fr/ apache2-default/ labos/ parasitologie/ anglais/ Candida.html reprise de l'exemple sans la page sur les modèles thomiens en SVT sur ce site |
dynamique de la morphogenèse de Candida albicans en fonction du gradient de dioxygène et de l'âge de la colonie 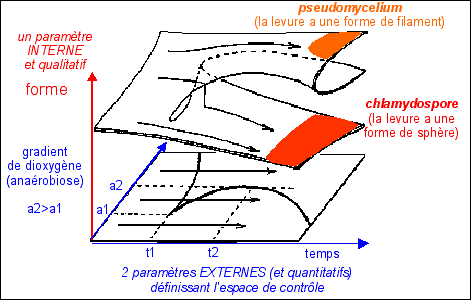 |
||||
|
|
||||||
|
|
||||||
|
3.3. Les paysages phénotypiques de l'organisme pluricellulaire encore inaccessibles |
+ le paysage morphogénétique le plus global résulte du développement de la blastula physiologique* (René Thom )
voir annexe en bas de page |
la tentative la plus
novatrice: «...il faudrait décrire aussi explicitement que possible la figure de régulation de l'être vivant (blastula physiologique), de l'homme en particulier, et y spécifier la place particulière du psychisme, et ceci de manière « ontogénétique ». Il faudrait aussi être capable de définir l'embryologie (l'ontogenèse) des fonctions organiques, un problème qui pose des difficultés formelles, car une fonction physiologique, en principe, est un être abstrait, formel, susceptible d'une définition ne varietur, donc incapable d'évoluer temporellement. Que les topiques freudiennes nous montrent le chemin, c'est, je crois, indéniable, mais il faudrait les meubler pour exprimer les contraintes spatiales et biochimiques de la reproduction, au moins les plus grossières que nous connaissons.» (René Thom, œuvres complètes, 1994f2.pdf, p 9) |
||||
|
|
||||||
|
+ les puits de potentiel figurant aussi bien les gradients morphogénétiques embryonnaires que les figures stables de régulation physiologique comme l'homéostase.
René Thom in œuvres complètes: 1984f12.pdf
pour la causalité
voir |
c'est la formulation la plus proche du
paysage épigénétique de Waddington
|
en travaux
|
||||
|
« Dans un phénomène tel que la coagulation du sang, on est amené à écrire un diagramme complexe de réactions causales entre diverses substances (thrombine, prothrombine, facteurs, etc.). Lorsqu'on essaye de prolonger ce diagramme vers le passé pour isoler les « causes ultimes » du phénomène, on observe qu'il va en se ramifiant quasi indéfiniment, en sorte qu'à la limite, une minime impureté suffirait à elle seule à déclencher tout le processus. Il serait raisonnable, dans cette situation, de parler de « causalité diffuse ». Beaucoup - devant un tel cas - invoquent l'aléatoire, mettent en cause le déterminisme et se réfugient dans la statistique. Avant d'en venir là, il pourrait être utile de voir si la structure globalement convergente du schéma causal ne pourrait être modélisée comme un gigantesque puits de potentiel, dont le potentiel s'interpréterait comme une qualité occulte, une vertu efficiente. Mais en biologie, on a été si longtemps prémuni contre la métaphysique des qualités qu'on se refuse à cette considération. Et cependant, ayant à choisir entre le Charybde de l'aléatoire et le Scylla du métaphysique, ne vaudrait-il pas mieux, à tout prendre, choisir ce dernier ? Claude Bernard - en strict positiviste - s'est abstenu de toute théorie concernant l'analyse causale et la formation d'hypothèses. Francis Bacon, lui, n'a pas hésité à développer toute une métaphysique des qualités (les « formes »), qui se distinguaient fort peu des « species » de l'École (et cela en dépit de son anti-aristotélisme déclaré). Claude Bernard, à cet égard, critique Bacon pour ne pas s'être détaché de l'aristotélisme et n'avoir pas usé de la « vraie méthode expérimentale (fondée sur les mathématiques) inaugurée par Galilée ». En cela il fait preuve d'inconséquence. Car son propre raisonnement causal ne dépasse en rien la causalité aristotélicienne. L'esprit philosophique n'était sans doute pas son fort, mais il avait beaucoup mieux : une prodigieuse intuition holistique des faits du métabolisme vital. La constance du milieu intérieur - sa plus belle découverte - pouvait-elle être autre chose qu'une idée a priori, provenant d'une intuition globale de l'unité de l'organisme, projetée dans le substrat biochimique de l'organisme ?». |
||||||
|
|
||||||
|
+ des modèles mathématiques en médecine intégrant les données génétiques, héréditaires, épidémiologiques... |
l'exemple de la phénylcétonurie me paraissait être un des plus accessibles... finalement seule l'alcaptonurie s'est révélée l'être quelque peu. Mais ces maladies se prêtent beaucoup moins que prévu à des modèles mathématiques... j'y travaille. |
en travaux |
||||
|
« J'ai proposé un
modèle dynamique de l'embryologie du noyau dur
des fonctions organiques universelles : celui de la
blastula physiologique
(note10: Cf. «
Ambiguïtés de la complexité en biologie
»). Ce modèle offre une
possibilité de résoudre le problème de
l'embryologie des fonctions ; de plus la
concaténation des cycles d'hystérésis
est une image de l'asservissement d'une fonction (1)
à une fonction (2) (note 11:
Concaténation des cycles par règle de la
coïncidence des coplis. Cf.. « La notion de
programme en biologie », [n.e, 1984,
5]). Le problème essentiel est de
comprendre la localisation des fonctions, leur manifestation
dans la structure visible.
|
|
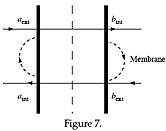 |
Le cas le plus simple est celui des strates de codimension 1 : les membranes, ou muqueuses, qui séparent deux milieux différents, entre lesquels elles assurent des transferts de flux à valeur régulatoire. Là, la localisation est du type de celle imposée à un « lieu de catastrophe » dans le modèle de la théorie des catastrophes. On ne peut guère - à mon sens - parler de la fonction d'une membrane, si ce n'est sous forme cyclique : si la membrane sépare les milieux a et b, alors les transferts a->b et b-> a impliquent des métabolites différents (aext, à la sortie, aint à l'entrée), de sorte que le schéma général est cyclique (fig. 7). |
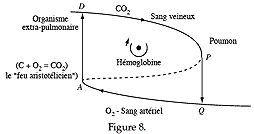
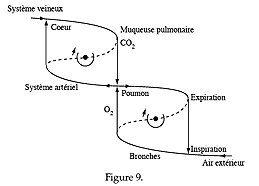
|
Considérons dans cet esprit la fonction « circulation sanguine ». Elle est caractérisée par le cycle de la figure 8, auquel il faut ajouter le cycle de la respiration (fig. 9). |
|
  |
Chez les vertébrés
(supérieurs) le centre organisateur,
l'âme de la fonction « circulation »,
s'est localisé dans le cœur ; il s'est
réalisé spatialement par l'accolement de deux
tubes pulsatiles correspondant aux « links » des
arêtes DP, QA de la figure 8 plongée dans
R3. Je proposerai pour la représentation
formelle de la relation structure-fonction les principes
suivants : |
|
|
|