Des
cancers
Avertissements:
* cette page a
pour but de
poser les
questions
BIOLOGIQUES
et
d'y
répondre
à
l'aide de
données
BIBLIOGRAPHIQUES.
* j'y ai
ajouté
quelques
données
récentes
sur la
TOFT(théorie
du
champ
d'organisation
tissulaire)
en 2006.
* si
initialement,
cette page,
écrite
en 2002,
était
prétexte
à
réhabiliter
le travail de
Beljanski,
je
m'étais
bien
gardé
de donner des
informations
sur
les
thérapies.
J'ai fini, en
2007, par y
ajouter une
petite
remarque sur
les
traitements
anti-cancéreux
, même
si
ces
informations
n'ont pas
de
caractère
MÉDICAL.
Sources
pour
la
TOFT:
Site de
diffusion des
savoirs de
l'ENS:
conférence
A. Soto
(université
Tufts de
Buenos Aires)
en anglais:
http://www.diffusion.ens.fr/index.php?res=conf&idconf=1088)
Le champ
d'organisation
tissulaire
[27
février
2006
à
10h30] et
bibliographie
de cet auteur
et Carlos
Sonnenschein.
autres
sources:
Le
cancer
résiste
à la
science,
Laurent
Schwartz, La
Recherche,
284,
février
1996, p 54-60;
Encyclopedia
Universalis (version
5)
articles
"culture
d'explants" de
Michel Sigot,
"tumeurs
végétales"
de Pierre
Manigault;
"oncogénèse
et "cancer"; L'apparition
des
cancers,
Robert
Weinberg, Pour
la Science,
Dossier
Hors-Série,
avril 1998, p
98-105; La
dissémination
des
cellules
cancéreuses,
Erkki
Ruoslahti,
Pour la
Science,
Dossier
Hors-Série,
avril 1998, p
106-109; Le
Cancer,
Gilles Thomas,
Dossier Pour
la Science,
Hors
Série,
octobre 1995,
p 57; Le
Cancer,
Gilles Thomas,
Dossier Pour
la Science,
Hors
Série,
octobre 1995,
p 57;
Vers une
prévention
hormonale du
cancer du
sein,,
Philippe
Touraine,
Pascale This
et Pierre
Mauvais-Jarvis,
Dossier
Pour la
Science, Hors
Série,
octobre 1995,
p 58-63; Le
cancer
de la prostate,
Marc Garnick,
Dossier Pour
la Science,
Hors
Série,
octobre 1995,
p 64-70; Le
cancer du
poumon,
Alain
Livartowski,
Dossier Pour
la Science,
Hors
Série,
octobre 1995,
p 71-72; Le
mélanome
malin,
Louis
Dubertret,
Dossier Pour
la Science,
Hors
Série,
octobre 1995,
p72-73; La
formation des
métastases
cancéreuses,
Lance Liotta,
Dossier Pour
la Science,
Hors
Série,
octobre
1995, p 74-79;
Le cancer
colorectal,
Sylviane
Olschwang,
Dossier Pour
la Science,
Hors
Série,
octobre 1995,
p 82;
L'adhérence
des cellules,
Alan Horwitz,
Dossier Pour
la
Science, Hors
Série,
avril 1998, p
72-79 ; Beljanski,
un
novateur en
biomédecine;
concepts,
théories,
applications;
C.-G. NORDAU
et M.S.
BELJANSKI,
éd. EVI
Liberty Corp,
2001
La
piste
métabolique
du cancer,
Pierre Kaldy,
La Recherche,
407, avril
2007, 24
plan
de cette page
- Qu'est-ce
que le cancer
?
- 1.1
L'hypothèse
génétique
: la SMT (théorie
des mutations
somatiques)
- 1.1.1 De
l'hypothèse
nucléaire
à
l'hypothèse
des mutations
somatiques en
passant par
l'hypothèse
virale
- 1.1.2 Le
cancer comme
déstabilisation
de l'ADN
- 1.1.3 des
cellules
cancéreuses
en culture in
vitro aux
tumeurs in
vitro et in
vivo
- 1.2
L'hypothèse
tissulaire: la
TOFT (théorie
du champ
d'organisation
tissulaire)
Remarque
2007: traiter
le cancer
- "Cancers"
végétaux
- 2.1 Les
cultures in
vitro,
point de
départ
des
études
sur les
tumeurs
végétales
- 2.2 Les
tumeurs
végétales:
crown-gall,
tumeurs
à virus
et tumeurs
spontanées
des hybrides
- Cancers
animaux
- 3.1 Des
cultures de
cellules aux
cultures de
tissus animaux
- 3.2 Les
cultures de
cellules
cancéreuses
- Ouverture
de la
chaîne
de l'ADN, hypo
et
hyperchromicité
- Du
test d'Ames
à
l'Oncotest
- 5.1 Le
test d'Ames
mesure le taux
de
réversion
de souches
bactériennes
mutagènes
- 5.2
L'Oncotest
mesure
l'intensité
de la
réplication
de l'ADN de
cellules
cancéreuses
et saines
retour page
d'accueil,
génétique
1.
Qu'est-ce que
le cancer ?
Petit
à
petit, du fait
de
l'omniprésence
du
paradigme
molécularo-génétique,
tout cancer
s'est vu
interprété
comme un
dérèglementgénétique.
Mais on
voit poindre
une autre
théorie
qui va de pair
avec
l'accumulation
des
écarts
au paradigme
dominant.
Le cancer
(du
latin cancer=crabe
par
allusion
à une
maladie qui
ronge
l'organisme ou
à la
forme de
certaines
tumeurs: une
masse
spongieuse
d'où
partent
des
ramifications
telles les
pattes d'un
crustacé
comme le
décrit
Galien:
«Une
tumeur qui
s'étend
des deux
côtés
par des
prolongements
anormaux qui
envahissent
les
tissus
adjacents.
Cela ressemble
aux pattes
d'un crabe qui
sont elles
aussi
présentes
tout le long
de la
tête et
du corps de
l'animal»)
est une
prolifération
anormale de
cellules chez
un
pluricellulaire
formant ainsi
des amas ou
tumeurs
(c'est la
tumorisation
ou
tumorigénèse
ou
encore
l'oncogénèse)
qui se
développent
localement (on
ne
connaît
donc que des
tumeurs
végétales
et animales).
La migration
pour
l'invasion
souvent fatale
d'autres
tissus par des
cellules
issues de ces
tumeurs
(cancérisation
proprement
dite) n'existe
que chez les
animaux
et l'homme. L'oncologie
(du grec ontos=tumeur)
qui est
l'étude
des tumeurs,
reste
cependant
pratiquement
l'équivalent
du terme cancérologie.
Cependant,
si l'on
s'intéresse
à la
partie
biologique
comme dans
cette page,
c'est
l'oncogénèse
et la phase
d'invasion
par les
métastases
(malignité)
qui font notre
sujet et
non les
différents
aspects des
maladies
cancéreuses
(épidémiologie,
dépistage,
clinique,
thérapeutique...).
1.1
L'hypothèse
génétique
: la SMT
(théorie
des mutations
somatiques)
On pense
depuis fort
longtemps que
l'origine du
cancer est un
défaut
de
communication
d'une cellule
avec les
autres
cellules
qui
l'entourent.
Une cellule
devient
cancéreuse
lorsqu'elle
ne
répond
plus ou
répond
mal aux
signaux qui
contrôlent
la
prolifération
cellulaire
dans un
organisme
pluricellulaire.
L'oncogénèse
désigne
le processus
de précancérisation,
c'est-à-dire
de formation
d'une tumeur.
Du fait de la
proximité
des termes et
du
développement
quasi exclusif
de la
recherche
génétique
en
cancérologie,
il
est
aisé de
confondre ce
mécanisme
biologique
avec les
seules causes
génétiques
à cette
tumorisation.
De ce point de
vue,
strictement
génétique,
la
tumorisation
est
rapportée
à des
gènes
nommés
oncogènes,
mais ce
gènes
ne sont
pas bien
sûr la
seule cause de
l'oncogénèse.
De
la même
manière
ont
été
découvert
des
gènes
viraux dits
oncogènes,
intervenant
dans le
processus de
cancérisation.
Ces
gènes
viraux ne sont
pas non plus
les seuls
oncogènes.
Tous ces
éléments
sont
basés
sur une
compréhension
au niveau
cellulaire,
avec une
hypothèse
implicite
qui est que si
le cancer est
une
prolifération
cellulaire
anormale, l'état
normal
d'une cellule
est la quiescence
(ou l'absence
de
division).
De
très
nombreux
éléments
qui mettent
tous en
avant des
interactions
tissulaires,
sont venus
contredire la
théorie
classique -
nommé
SMT (somatic
mutation
theory) -.
Une version
améliorée
de la SMT a vu
le
jour avec la
considération
des
interactions
tissulaires
considérées
comme des
phénomènesépigénétiques.
Mais il existe
un
fort courant
qui propose
une approche
théorique
radicalement
différente
(voir paragraphe
suivant).
1.1.1 De
l'hypothèse
nucléaire
à
l'hypothèse
des mutations
somatiques en
passant par
l'hypothèse
virale
Boveri, en
1914 avait
noté
que les
structures
nucléaires
des cellules
tumorales
malignes
diffèrent
très
fréquemment
de celles des
cellules
normales et
supposé
qu'elles
étaient
la marque de
modifications
du
patrimoine
héréditaires
survenues dans
une cellule au
sein d'un
tissu et
qu'elles
étaient
la cause des
aberrations
de
comportement
des cellules
malignes.
Les
biologistes
danois
Ellerman et
Bang (1908)
ont
montré
que
la
leucémie
du poulet
était
transmissible
par des
extraits
cellulaires
filtrés
et peu
après
les travaux
de Peyton Rous
conduisirent
à
l'identification
du virus
sarcomatogène
de Rous,
premier virus
à
l'origine de
tumeurs
cancéreuses.
Depuis son ARN
a
été
séquencé
et la
transcriptase
inverse dont
il
possède
le gène
(pol) a
été
identifiée.
Cette enzyme
lui permet
d'être
intrégré
au
génome
de la cellule
transformée
sous forme
d'une
molécule
d'ADN
(provirus).
Un gène
dit
sarcomatogène
(src),
indispensable
au pouvoir
tumorigène,
a
été
identifié.
L'expression
du gène
src aboutit
à la
production
d'une
protéine
phosphorylée
d'une masse de
60 kDa,
la
protéine
pp60src,
qui
possède
une
activité
tyrosine
protéine
kinase. Ce
gène
s'est
finalement
révelé
être
d'origine
cellulaire
et non virale
car, en 1976,
Stéhelin,
Varmus et
Bishop
démontrèrent,
grâce
à des
techniques
d'hybridation
moléculaire
entre ARN
viral et ADN
de cellules
de poulet non
infecté,
que le
gène
sarcomatogène
viral,
appelé
maintenant v-src,
provient d'un
gène
cellulaire, c-src,
dont l'ARN a
été
ajouté
à l'ARN
viral au cours
de
précédents
cycles de
réplication.
Ce gène
cellulaire,
indispensable
à la
tumorisation
due au virus,
a
été
qualifié
d'oncogène.
On pense
habituellement
que la
conversion du
proto-oncogène
c-src en
oncogène
viral v-src est
le
résultat
d'une
dérégulation
de
l'expression
du
gène.
En outre, au
cours de la
formation du
virus
sarcomatogène
de Rous, on
observe des
réarrangements
et
mutations de
la
région
codante de c-src.
Fort de cette
expérience
on a
recherché,
pour les virus
à
l'origine de
tumeurs, soit
des
oncogènes
dans le
génome
viral, soit
des
proto-oncogènes
à
proximité
du point
d'insertion du
provirus dans
la cellule
transformée
(par exemple
le
proto-oncogène
c-myc
pour le
virus de
leucose
aviaire). La
chasse aux
proto-oncogènes
a
été
fructueuse, on
en
connaît
une centaine,
mais
décevante:
on y trouve
des
molécules
aussi
variées
que des
facteurs de
croissance,
des
protéines
possédant
une
activité
enzymatique
tyrosine
protéine
kinase, des
protéines
à
activité
GTPasique, ou
des
protéines
nucléaires
à
plus ou moins
forte
affinité
pour l'ADN.
L'incompréhension
a
culminé
avec ce qu'on
appelé
les
gènes
suppresseurs
de tumeurs
ou
anti-oncogènes
dont
l'existence a
été
postulée
à la
suite des
expériences
d'hybridation
cellulaire,
car, dans le
cas de fusion
d'une cellule
non
tumorigène
avec une
cellule
tumorigène,
la cellule
résultante
est quasiment
toujours non
tumorigène.
Le rôle
tumorigène
des virus
à ADN,
comme
certains virus
de papillomes
humains (HPV),
a
été
beaucoup plus
difficile
à
établir.
Finalement
l'hypothèse
de l'origine
nucléaire
des
cancers de
Boveri a
été
reformulée
dans les
années
1980 pour
devenir
l'hypothèse
des mutations
somatiques
comme
origine des
cancer (SMT somatic
mutation
theory),
plus ou moins
dépendante
des virus
puisque
ceux-ci sont
interprétés
comme des
agents
mutagènes.
Plus de 150
mutations ont
été
repérées
dans les
cellules
cancéreuses.
Ces
mutations,
parfois
héréditaires,
sont donc
considérées
comme la cause
directe de
l'apparition
de
tumeur. Pour
certains
gènes,
le cancer va
jusqu'à
être
considéré
comme une
maladie
génétique
et l'on
applique sans
hésiter
les
"lois" de
Mendel
à la
transmission
de cancers
dits
héréditaires
ou familiaux
comme le
rétinoblastome.
1.1.2 Le
cancer comme
déstabilisation
de l'ADN
Ces
explications
ne sont pas
convaincantes.
On est
emmené
dans une
quête
sans fin de
gènes
de
prédisposition
dont on ne
connaît
même pas
la
fonction, chez
des organismes
extrêmement
différents
les
uns des
autres, quand
ce n'est pas
la recherche
de ces
gènes
dans des
cultures de
cellules non
plus hybrides
mais
chimères
(mélanges
de plusieurs
espèces).
La
cancérisation
touche le travail
de relation
entre
cellules d'un
tissu
différencié,
elle touche
aussi le
travail de
reproduction
dans l'aspect
du
renouvellement
cellulaire et
de son
contrôle.
Il est
évident
à
tous qu'il
existe plus
qu'une simple
comparaison
entre les
mécanismes
de
contrôle
de la
prolifération/renouvellement
cellulaire et
les
mécanismes
de l'ontogénèse.
On aurait
donc pu
s'attendre
à une
théorie
générale
de
la
cancérisation,
au minimum
organique
(définie
au
niveau des
organes).
Mais, on a
uniquement une
théorie
cyochimique et
cytogénétique.
En effet, tout
comme dans le
cas de
l'embryogénèse,
la piste
génétique
a
été
aussi celle de
prédilection
dans les
études
sur le cancer.
On en a
peut-être
aussi
oublié
que l'on
travaillait
sur
des cultures
de cellules
isolées,
que les seules
paramètres
de la
tumorisation
qui pouvaient
être
dès
lors
étudiés
étaient
des
paramètres
moléculaires
car ils
étaient
les
seuls à
être
conservés.
On s'est
focalisé
encore une
fois sur les
gènes
et l'on a
peut-être
un peu
perdu de vue
l'ADN,
molécule
manipulée
par une
cellule,
devenue
cancéreuse.
Tout comme R.
Chandebois le
propose, avec
la progression
autonome et le
comportement
individuel des
cellules
(voir page
sur le
développement),
il
existe au
moins une
piste
exogène
sérieuse
et
documentée
pour le
cancer: celle
des travaux de
M.
Beljanski.
En reprenant
les termes de
Laurent
Schwartz (dans
Le cancer
résiste
à la
science,
Laurent
Schwartz, La
Recherche,
284,
février
1996, p
54-60):
«La
guerre
contre le
cancer n'est
pas
forcément
perdue, mais
les espoirs
nourris dans
les
années
1970 se sont
révélés
en grande
partie vains.
[...]
Des
progrès
considérables
ont certes
été
effectués
dans la
compréhension
des processus
cancéreux.
mais ils ne
permettent
d'identifier aucun
gène
qui soit
propre
à ce
processus.
Toute
protéine
synthétisée
dans une
tumeur peut
l'être
dans une
cellule normale.
Cette
absence de
spécificité
de la cellule
cancéreuse
est
un obstacle
majeur tant
à la
chimiothérapie
qu'à
l'immunothérapie
et à la
thérapie
génique.
Un signe de
l'échec
parmi
d'autres: les
compagnies
pharmaceutiques
ne tirent des
anticancéreux
que 2%
de leur
chiffre
d'affaire.»
(personnellement
je
trouve que
cela fait
déjà
un beau
pactole, ce
qui
justifiera
certaines
prises de
position dans
la politique
de
recherche
contre le
cancer).
En tout cas
ces phrases
sont
claires et
cela fait de
nombreuses
années
que M.
Beljanski
répond
de
façon
statisfaisante,
pour ce que je
peux en
juger,
à ces
objections.
Ces approches
n'ayant pas
accès
à la
une des
médias,
je ne les
connais sans
aucun doute
pas toutes. Je
pense que je
peux sans
hésiter
leur faire une
place dans un
cours de
biologie qui
cherche
à
éveiller
de jeunes
esprits en
incitant
fortement des
futurs
chercheurs
à
travailler sur
une
bibliographie
originale
complète
à
laquelle je
n'ai pas
accès.
Les travaux de
M. Beljanski
consistent en
une approche
du cancer qui
prend en
compte une
faculté
commune
à
toutes les
cellules
cancéreuses:
celle de
répliquer
de
façon
importante
l'ADN. Elle a
donné
lieu à
un test qui
mesure le
degré
de
toxicité
d'une
substance
chimique en
regard avec la
stimulation
par cette
substance de
la
synthèse
de
molécules
d'ADN
extraites de
cellules
cancéreuses
et
non
cancéreuses
(voir oncotest
ci-dessous).
L'idée
fondamentale
peut
être
résumée
par
le
schéma
suivant:
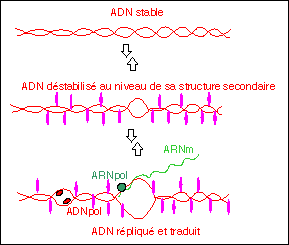
Représentation
schématique
de la
déstabilisation
de
la
molécule
d'ADN par des
substances
chimiques
cancérogènes
(en
violet) .
L'ouverture de
l'hélice
d'ADN, rend
plus
accessible ou
au
contraire
moins
accessible
certains
gènes
aux complexes
enzymatiques
de
réplication
(ADN
polymérase)
et de
transcription
(ARN
polymérase).
Ce
schéma
est une
illustration
théorique
(d'après
Beljanski,
un novateur en
biomédecine,
p 42).
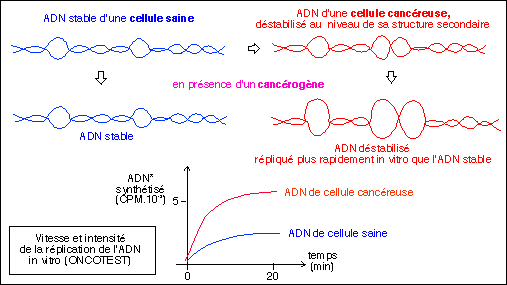
Une
illustration
du principe de
l'Oncotest
basé
sur la
déstabilisation
de l'ADN des
cellules
cancéreuses
par rapport
à celui
des cellules
saines.
D'après
"La
santé
confisquée",
Monique et
Mirko
Beljanski, EVI
Liberty Corp.,
1999,
4ème
édition
augmentée,
p 25
1.1.3 des
cellules
cancéreuses
en culture in
vitro
aux tumeurs in
vitro et in
vivo
Dès
1970
l'utilisation
de cultures
cellulaires de
cellules
tumorales a
permis des
progrès
rapides (voir
plus
bas dans
cette page).
Des
lignées
référencées
de cellules
tumorales
animales et
humaines sont
ainsi à
la disposition
de certains
groupes de
recherche
(publics ou
privés)
qui les
conservent
soigneusement.
|
In vitro
les cellules
tumorales
peuvent se
distinguer des
cellules
normales par
- une moindre
adhérence
au substrat
pouvant
s'accompagner
de la
capacité
à
proliférer
en suspension
et former des
colonies
sphériques
dans un milieu
partiellement
gélifié
(par de
l'agar),
- une morphologie
moins aplatie
- la perte de
l'inhibition
de contact,
ce qui permet
aux cellules
tumorales de
former de
multiples
couches de
cellules,
même sur
support solide
- une
prolifération
en
présence
de faibles
quantité
des facteurs
de croissance
présents
dans le milieu
(ce qui se met
facilement en
évidence
lors du
repiquage des
souches
tumorales car
des souches
normales ne se
développent
pas dans les
conditions de
culture
suffisantes
pour des
souches
tumorales)
- et une
aptitude
à
former des
tumeurs,
lorsqu'on les
greffe
à un
organisme (des
hyperplasies
ou
excroissances
comme les
galles chez
les
végétaux
peuvent
rapeller les
tumeurs mais
ne peuvent se
développer
à le
suite d'une
greffe, ce qui
permet de les
différencier
des vraies
tumeurs qui
peuvent
toujours se
greffer et
proliférer
chez
l'hôte).
Pour
éviter
les rejets
immunitaires
de greffes, on
utilise dans
l'étude
des cancers
chez la
souris, des
souris nude,
dépourvues
de thymus, qui
acceptent
mêmes
les greffes de
cellules
humaines.
Un
élément
important mais
qui demande
à
être
vérifié
est la polarisation
inverse de la
membrane
cellulaire,
négative
extérieurement
et positive
intérieurement,
ce qui est
l'inverse de
la
polarisation
des cellules
normales de
l'organisme.
Cette
polarisation
inverse
pourrait
expliquer la
pénétration
de certaines
molécules
chargées
positivement
qui
normalement ne
passent pas la
membrane
chargée
négativement.
|
Le premier
stade de la
maladie ou
précancérisation
correspond
à des
cellules qui
se divisent et
forment des tumeurs
bénignes
car ne migrant
pas dans
d'autres
parties de
l'organisme.
Ces tumeurs
peuvent
être
supprimées
par
chirurgie ou
par
radiothérapie,
une fois
qu'elles sont
en
phase
clinique,
c'est-à-dire
suffisamment
grosses pour
être
détectables.
Entre le
début,
silencieux, du
premier stade
et le
début
du second
peuvent
s'écouler
des dizaines
d'années.
Le
deuxième
stade est
celui des métastases,
colonies de
cellules
cancéreuses
invasives
migrant par le
sang
ou la lymphe
vers d'autres
organes et y
formant des tumeurs
malignes.
Le processus
de
transformation
de cellule
bégnine
en maligne est
franchement
inconnu
même si
des
pistes sont
exploitées
dans le
domaine de
l'adhérence
des cellules
aux matrices
extra-cellulaires
et dans le
domaine de la
résistance
à
l'apoptose
qui,
normalement,
toute toute
cellule de
tissu qui
n'est plus
ancrée
à sa
matrice-support.
On ignore
aussi pourquoi
certains
tissus comme
le
cartilage sont
exempts de
métastases.
Seuls les
vaisseaux
cérébraux
sont
touchés,
le tissu
nerveux
cérébral
est aussi
indemne. (voir
La
dissémination
des cellules
cancéreuses,
Erkki
Ruoslahti,
Pour la
Science,
Dossier
Hors-Série,
avril 1998, p
106-109)
Les cancers
sont
responsables
en France du
quart des
décès
(32% chez les
hommes et 23%
chez les
femmes).
1.2
L'hypothèse
tissulaire:
la TOFT
(théorie
du champ
d'organisation
tissulaire)
La prolifération
tissulaire
serait vue
comme
l'état
par
défaut
des cellules;
cette
théorie
a
pris le nom de
tissue
organization
field
theory of
carcinogenesis
and metastasis
(TOFT).
Site
de diffusion
des savoirs de
l'ENS:
conférence
A. Soto
(université
Tufts de
Buenos Aires)
en anglais: http://www.diffusion.ens.fr/index.php?res=conf&idconf=1088)
Le champ
d'organisation
tissulaire
[27
février
2006
à
10h30]
Dans
cette
théorie,
le niveau de
compréhension
du cancer est
celui du tissu
et non plus
des cellules.
Le cancer
devient un
problème
d'organisation
tissulaire
proche de
celui
de l'organogénèse.
Des
expériences
récentes
réalisées
à
partir
d'hybridations
tissulaires
notamment de
tissus
prostatiques,
permettent de
contrôler
in vitro
l'apparition
de
phénotypes
cancéreux
et de les
transmettre
à
d'autres
tissus
(http://endo.endojournals.org/cgi/reprint/146/1/13).
Voir par
exemple
Endocrinology
Vol. 146, No.
1 11-12, 2005,
Are
Times a'
Changin' in
Carcinogenesis?
Carlos
Sonnenschein
and Ana
M. Soto (accessible
gratuitement http://endo.endojournals.org/cgi/content/full/146/1/11
- voir
bibliographie
de cet auteur).
Un autre
argument a
été
fourni
récemment
par
une
gigantesque
étude
américaine
(5 millions de
dollars) sur
les cancers du
sein et du
colon.
L'article
original est
technique
(The
consensus
coding
sequences of
human
breast and
colorectal
cancers,
T. Sjoblom et
al.,
Science.
2006 Oct
13;314(5797):268-74)
et l'on
peut lire plus
facilement la
brève
de La
Recherche: Les
tumeurs
du sein et du
côlon
séquencées,
Marie-Laure
Moinet, La
Recherche, nov
2006, 402, 22.
Le travail
consistait
à
comparer la
séquence
de 13.023
gènes
bien connus
chez 11
malades
atteints de
cancers du
sein
et 11 atteints
de cancers du
colon,
à celle
de ces
mêmes
gènes
chez des
individus
sains de
référence
à
partir duquel
la base de
séquence
est
construite.
En moyenne
chaque malade
présentait
environ 90
gènes
"mutés"
c'est-à-dire
dont la
séquence
différait
de la
séquence
de
référence
de
façon
importante.
Mais ces
gènes
n'étaient
pas du tout
identiques
chez tous les
malades.
En
éliminant
les
gènes
qui ne
semblaient pas
intervenir
dans la
genèse
des tissus
cancéreux
(!!!) les
chercheurs ont
identifiés
environ 11
gènes
par patient
qui
présentaient
de nombreuses
"mutations",
soit 189 au
total
qu'ils ont
comparé
par des
méthodes
informatiques.
La plus
grande partie
de ces
gènes
n'étaient
pas
considérés
comme
génétiquement
altérés
dans les
tumeurs et
sont
supposés
intervenir
dans une large
gamme de
fonctions
cellulaires
parmi
lesquelles la
transcription,
l'adhésion
ou l'invasion
(The
vast majority
of these genes
were not known
to be
genetically
altered in
tumors and are
predicted to
affect a
wide range of
cellular
functions,
including
transcription,
adhesion,
and invasion).
L'idée
de
"gènes
du cancer" a
pris un
nouveau coup
dans l'aile.
Une fois de
plus,
plutôt
que de changer
de
théorie,
les
chercheurs
américains
ont obtenu une
rallonge de
100 millions
de dollars
pour continuer
le
séquençage
de ces
mêmes
gènes
pour les
cancers du
poumon, du
cerveau et de
l'ovaire (in
brève
de La
Recherche).
Remarque
2007: traiter
le
cancer
La
compréhension
du
phénomène
biologique
conditionne
bien
évidemment
le traitement.
* La plupart
des
anticancéreux
sont des antimitotiques
qui
empêchent
les divisions
et donc la
croissance des
tumeurs et la
prolifération
des
métastases.
* Beljanski,
qui s'est
heurté
à
l'industrie
pharmaceutique,
a
developpé
ses propres
anticancéreux
(ARN courts et
extraits
naturels...) (voir
le site du
CIRIS: http://www.beljanski.com/fran/accueil.html);
ils
sont toujours
commercalisés
aux USA:
http://www.natural-source.com/fran/
* Une
équipe
canadienne en
2006 et 2007
(Université
d'Alberta,
équipe
de E.
Michelakis)
s'est
attaqué
au
métabolisme
des cellules
cancéreuses.
En effet un
bon
marqueur
métabolique
semble
être la
consommation
augmentée
de glucose par
les cellules
cancéreuses
qui
développent
la voie
glycolytique.
L'accumulation
d'acide
lactique,
produit
de la phase
terminale de
la
fermentation
lactique qui
peut suivre la
glycolyse (voir
cours de TS
spécialité),
en
augmentant
l'acidité
de la cellule,
pourrait
favoriser la
dégradation
de la matrice
extracellulaire
et faciliter
ainsi
la
mobilité
des cellules
cancéreuses.
Pour l'instant
on
ne sait pas si
l'augmentation
de la voie
glycolytique
va de pair
avec
une baisse de
la respiration
mitochondriale
dans les
tumeurs.
Les
auteurs ont
fait des
essais
thérapeutiques
concluants
chez le rat
avec le DCA
(dichloroacétate),
qui est
un modulateur
métabolique
qui a
été
utilisé
chez l'homme
depuis des
dizaines
d'années
dans
le traitement
de l'acidose
lactique et
dans les
maladies
métaboliques
mitochondriales
héréditaires.
Le
DCA pourrait
devenir un
anticancéreux
bon
marché
mais
de peu
d'intérêt
financier.
L'équipe
de E.
Michelankis
s'est donc
lancée
seule contre
l'industrie
pharmaceutique
: http://www.depmed.ualberta.ca/dca/
et cherche 1,5
millions de
dollars.
(brève
en
français:
La
piste
métabolique
du cancer,
Pierre
Kaldy, La
Recherche,
407, avril
2007, 24
article
principal en
anglais
(autres
articles
dans
Nature...)
Bonnet S. et
al, A
Mitochondria-K+
Channel Axis
Is
Suppressed in
Cancer and Its
Normalization
Promotes
Apoptosis and
Inhibits
Cancer Growth,
2007, Cancer
Cell,
11, 1,
37-51)
retour
plan de la
page
2.
"Cancers"
végétaux
2.1 Les
cultures in
vitro,
point de
départ
des
études
sur les
tumeurs
végétales
Les cultures
in vitro
de cellules
végétales
n'ont
pas
été
aussi rapides
que l'on
pourrait le
croire.
Haberland,
dès
1902,
s'efforça
d'obtenir la
survie et la
multiplication
in vitro
de cellules et
tissus
(cellules de
poils
staminaux de
Tradescantia ,
poils
glanduleux
d'Ortie,
épiderme
de
Fuchsia ...).
La
première
culture
réussie
a
été
celle d'un organe
et non celle
d'un tissu,
à
l'inverse des
cultures de
cellules
animales. En
effet la
première
culture
racinaire
réussie
(qui englobait
le
méristème)
ne fut de
d'une
durée
de quelques
vingt semaines
vers 1922 (par
W. Kotte,
en Allemagne,
et par
W. J. Robbins,
aux
États-Unis).
Ce n'est que
dix ans plus
tard que
P. White
réussit
à
obtenir la première
culture
indéfinie
en cultivant
des
extrémités
de
racines de
tomates sur un
milieu
contenant des
sels
minéraux,
un sucre et de
l'extrait de
levure. Cette
souche
isolée
par
White, et
entretenue par
repiquages,
vit toujours
actuellement.
C'est
R. Gautheret
qui
réalisa
les premières
cultures
monocellulaires
in
vitro.
«En
1934, d'abord,
il utilisa le
tissu cambial
de divers
arbres tels
que saule,
hêtre,
peuplier,
orme, etc. (Le
cambium
est le
méristème
latéral
qui assure la
croissance en
épaisseur
des tiges et
des racines.
Tout comme
celles des
méristèmes
apicaux, les
cellules du
cambium
conservent
indéfiniment
leur pouvoir
de
multiplication.)
Explantés
à la
surface de
tampons de
coton
imprégnés
de solutions
nutritives ou
dans des
milieux
gélosés,
les fragments
de cambium
multiplient
leurs
cellules d'une
façon
intense et
anarchique,
produisant des
mamelons
parenchymateux
indifférenciés
qui peuvent se
développer
ainsi pendant
six à
huit mois;
au-delà
de cette
période,
les cultures
périclitent
et meurent car
elles ne
supportent pas
les
repiquages.
Puis, en 1939,
abandonnant le
tissu cambial
des arbres
pour les
tissus de
carotte,
Gautheret
réalisa
des cultures
sur
milieu
additionné
d'une solution
oligo-dynamique
(solution
contenant des
traces de sels
minéraux
divers tels
que cuivre,
manganèse,
nickel, zinc);
il
réussit
ainsi à
isoler une
couche
cellulaire qui
se
développe
de
façon
indéfinie,
par repiquages
périodiques,
tout comme les
cellules
animales»
(in E.U.
article
"culture
d'explants").
Cette
même
année,
en 1939,
P. Nobécourt,
en
France,
réalisait
aussi la
culture
histiotypique
de tissus de
carotte, et
P. White,
aux
États-Unis,
parvenait
à
cultiver les
tissus d'une
tumeur
produite
spontanément
par un
hybride de
tabac.
À
l'heure
actuelle, on
parvient
à
cultiver les
tissus de
presque toutes
les
espèces
végétales.
Ces
succès
sont dus en
grande partie
à
l'emploi de
l'auxine.
Les tissus
tumoraux sont
aussi
qualifiés
d'anergiés
(l'anergie
est le nom
donné
par R.
Gautheret aux
tissus de
tabac, qui
sous l'action
de l'auxine,
subissent une
transformation
tumorale).
2.2 Les
tumeurs
végétales:
crown-gall,
tumeurs
à virus
et tumeurs
spontanées
des hybrides
Le
crown-gall (du
nom de la
protubérance
cancéreuse
qui
apparaissant
au collet
(crown) de la
betterave
à la
suite d'une
blessure de la
plante
souillée
par de
la terre) est
une
véritable
cancérisation
ou
tumorisation
végétale.
Elle
représente
un
modèle
végétal
pour le
cancer animal
même si
la cellule
végétale
est
tout de
même
assez
différente
de la cellule
animale (la
paroi
notamment qui
à la
fois limite
certains
échanges
et en induit
d'autres par
voie
apoplasmique...)
et les tissus
végétaux
n'ont pas
réellement
la même
définition
que les tissus
animaux (du
fait des
communications
cytoplasmiques
entre les
cellules d'un
même
tissu, voir de
deux
tissus
adjacents par
les
plasmodesmes:
c'est la voie
symplasmique...).
On
connaît
plus de
140 espèces
de plantes,
Dicotylédones
ou
Gymnospermes,
sensibles au
crown-gall. La
cancérisation
nécessite
un
traumatisme,
puis la
pénétration
d'une
bactérie,
obligatoirement
vivante,
inductrice de
tumeurs: Agrobacterium
tumefaciens.
Les tumeurs
induites
peuvent se
repiquer ou se
greffer sur
d'autres
plantes,
même
entièrement
stériles,
ce qui permet
de qualifier
ces
tumeurs comme
véritablement
cancéreuses.
L'origine de
l'induction
repose sur
plusieurs
hypothèses,
ne
s'excluant pas
forcément:
*
l'hypothèse
virale: un
bactériophage,
associé
à la
bactérie
serait un
virus
"oncogène",
hypothèse
très
souvent
avancée
pour les
cancers
animaux;
*
l'hypothèse
génétique:
le
génome
de la
bactérie
contiendrait
un
oncogène
qui serait
libéré.
Cette
hypothèse
a
été
longement
travaillée
par M.
Beljanski et
ses
collaborateurs.
Le pouvoir
tumorigène
de la
bactérie
est lié
à un
ARN court
tumorigène
est
expulsé
et actif
en
présence
d'auxine
qui
déstabilise
l'ADN de la
cellule
végétale
et le rend
ainsi
réceptif
à l'ARN
tumorigène.
*
l'hypothèse
des facteurs
de croissance
tumorigènes
qui
a
été
approfondie
par Beljanski
et son
équipe.
On trouve dans
les cultures
de tissus
aseptiques des
acides
aminés
(opines ou
guanidines),
l'octopine,
la
nopaline
et la lysopine
qui n'existent
pas en
quantité
décelable
dans les
tissus sains.
La nature de
ces produits
dépend
de la
bactérie
qui a
été
à
l'origine de
la
cancérisation.
Telle
souche
engendre des
tumeurs
à
nopaline,
telle autre
des
tumeurs
à
octopine, et
ces
caractères
se
maintiennent
indéfiniment.
Ces substances
déstabilisent
l'ADN de la
bactérie
en
présence
d'auxine, tout
comme ells
déstabilisent
l'ADN des
propres
cellules
végétales
tumorales par
un effet de en
retour. Plus
une
cellule
présente
un ADN
déstabilisé,
plus elle
sécrète
des substances
déstabilisatrices
qui ont
été
nommées
des
marqueurs
cancéreux
par
Beljanski. Ces
marqueurs
tumoraux
induisent la
séparation
des
chaînes
de l'ADN des
cellules
tumorales et
des
bactéries
tumorigènes
sans avoir
d'effet
important sur
les cellules
normales. Les
marqueurs
cancéreux
trouvés
dans les
cellules
animales (AFP,
ACE,
calcitonine et
ferritine)
stimulent la
croissance des
tumeurs de
pois (Pisum
sativum),
de
chrysanthème
(Datura
stramonium),
de tabac
(Nicotiana
tabacum)
et de vgne
vierge (Parthenocissus
tricuspidata)
in vivo,
mais les
opines
n'agissent pas
sur
les tissus
cancéreux
de
mammifères
ni sur les
tumeurs
in vivo.
La kinétine,
autre hormone
végétale,
dont
on avait
noté le
pouvoir
antitumoral,
possède
la
propriété
inverse de
resserrer la
chaîne
d'ADN.
Il existe
deux autres
types de
cancérisation
végétale:
les tumeurs
à virus
et les tumeurs
spontanées
des hybrides.
retour
plan de la
page
3.
Cancers
animaux
3.1 Des
cultures de
cellules aux
cultures de
tissus animaux
La culture in
vitro de
cellules
animales a
été
un
succès
dès
1903. En
suivant les
protocoles
d'Haberland
-qui
étaient
des
échecs
pour la
culture in
vitro de
cellules
végétales-
le
Français
Justin Jolly
réussit
la culture des
globules
rouges de
triton (qui
sont
nucléés)
pendant 15
jours
(ensuite, le
rythme des
divisions
décroît
pour s'annuler
au bout de
quelques
mois). En
1907,
R. G. Harrison,
en
Amérique,
réalisa
la
différenciation,
in
vitro ,
des
ébauches
des racines
des nerfs
rachidiens
d'embryons de
Batraciens. Il
démontra
que les nerfs
ont un
accroissement
propre et
s'allongent au
fur et
à
mesure des
besoins. En
1912, Carrel
obtient une
culture stable
par repiquage
périodique
de
fibroblastes
de cœur
de poulet,
grâce
à
l'utilisation
d'un milieu
constitué
de plasma
auquel
il ajoute,
sous forme
d'extrait
d'embryons,
les substances
de
croissance.
Il faut bien
noter ici que
ce sont des
cellules qui
se mutliplient
et
recouvrent le
milieu de
culture d'un
voile
cellulaire.
Mais elles ne
reforment un
tissu
(l'explant
initial se
désorganise
et meurt)
avec la
structure que
ces cellules
établieraient
dans un
organe animal.
Contrairement
à
l'appellation
courante ce
sont
des
cultures de
cellules
(histiotypiques)
et non des
cultures de
tissus.
Cette
distinction
est
fondée
sur le
pouvoir
histologique
d'une cellules
qui repose sur
son
appartenance
à une
lignée
de cellules
embryonnaires
engagée
dans une
progression
autonome:
cette histoire
n'est pas
reproductible
par un
environnement
artificiel
(voir page
sur
le
développement).
Cependant la
cultture de
tissus et
d'organes
animaux
(Étienne
Wolff et Katy
Haffen, 1952)
est possible
pour de petits
fragments
d'organes ou
des organes
embryonnaires
(quelques
millimètres)
si l'on limite
l'apport des
substances de
croissance
(pour
éviter
la
multiplication
anarchique des
cellules), si
l'on
aère
convenablement
la culture
(permettre une
bonne
respiration
cellulaire
malgré
l'absence
d'irriguation
fonctionnelle),
si l'on
empêche
les fuites de
cellules en
dehors de
l'organe en
fournissant
à la
culture un
substrat
inhibant le
déplacement
cellulaire
comme le gel
d'agar
(insuffisamment
solide).
La culture la
plus
utilisée
est celle de
fibroblastes
embryonnaires
(très
belles prises
de vue en
microcinématographie
dans le
nouveau
document APBG:
la
peau).«
La mise en
culture de
cellules
dérivées
d'embryons
d'oiseaux ou
de rongeurs se
fait dans des
milieux de
culture
comportant 10%
de
sérum
de veau
fœtal
comme
source de
facteurs de
croissance,
d'hormones et
de
protéines
qui permettent
l'attachement
des cellules
à la
surface du
récipient
de culture.
Les
fibroblastes
embryonnaires
considérés
comme normaux
adhèrent
fortement au
récipient
de culture et
prolifèrent
jusqu'à
ce
qu'ils forment
une seule
couche de
cellules
recouvrant
toute la
surface qui
leur est
offerte. Leur
prolifération
s'arrête
alors dans un
état
qu'on appelle
inhibition de
contact. Pour
obtenir une
nouvelle
population de
fibroblastes
proliférants,
il faut
détacher
les cellules
du
récipient
grâce
à un
traitement
ménagé
par une enzyme
protéolytique
appropriée
(trypsine) et
les
réensemencer
dans de
nouveaux
récipients
en nombre tel
que les
cellules qui
vont
à
nouveau
s'attacher ne
recouvrent pas
la
totalité
du
flacon. Cette
opération
pourra
être
répétée
avec
succès
plusieurs
fois.
Cependant,
après
un certain
nombre de ces
passages en
culture,
on assiste
à un
phénomène
appelé
crise,
au cours
duquel les
fibroblastes
perdent leur
aptitude
à se
multiplier et
finalement
meurent.»
L'exposition
à
certains
agents
(cancérogènes
et viraux)
permet de
continuer
à
repiquer une
culture de
façon
indéfinie
mais cette
transformation
se fait avec
des
modifications
morphologiques
de la souche
(voir les
caractéristiques
ci-dessus).
3.2 Les
cultures de
cellules
cancéreuses
Les cultures
indéfinies
de cellules
cancéreuses
sont
utilisés
dans le monde
entier mais
tout
patrticulièrement
deux souches:
la souche
KB,
isolée
par
H. Eagle
à
partir d'un
épithélioma
humain du
plancher
buccal, et la
souche
Hela,
isolée
par
G. O. Gey
à
partir d'un
cancer
épidermoïde
du col
utérin.
Leur
malignité
demeure
inchangée
au cours des
repiquages
successifs.
Les conditions
de culture
organotypiques
(pour organes)
ont
été
appliquées
avec
succès
lorsque
l'on veut
garder la
structure des
tissus
cultivés:
on peut
citer le cas
des cultures
de tumeurs
cancéreuses
par
Étienne
et
Émilienne
Wolff : une
métastase
hépatique
d'une tumeur
d'origine
digestive
(Z 200)
et un
épithélioma
muqueux du
côlon
descendant
(Z 516),
qui
prolifèrent
d'une
façon
très
intense depuis
1962 et 1963.
Depuis Okada,
en1962, on
réalise
des fusions
cellulaires
entre
cellules
cancéreuses
et cellules
normales
(technique
d'hybridation
cellulaire ou
technique des
hybridomes)
qui
produisent
notamment des
anticorps
monoclonaux
très
utilisés
en recherche.
retour
plan de la
page
4.
Ouverture de
la
chaîne
de l'ADN, hypo
et
hyperchromicité
Les purines
(A,G)et
pyrimidines
(T,C, U) de
l'ADN et de
l'ARN sont
des
composés
faiblement
basiques
(bases) mais
fortement
conjugées
(la ou les
doubles
liaisons sont
partagées
par les
différents
atomes du
cycle de la
molécule
aromatique).
Cette
conjugaison a
pour
conséquence
que toutes ces
bases
absorbent la
lumière
dans l'U.V..
Les
acides
nucléiques
sont
caractérisés
par une
absorption
maximale pour
une longueur
d'onde proche
de 260
nm.
Chaque
ribonucléotide
(ou
ribonucléoside)
ou
désoxyribonucléotide
(ou
désoxyribonucléoside)
présente
une spectre
d'absorption
de la
lumière
qui lui est
propre. Dans
les acides
nucléiques
ADN et ARN,
les liaisons
hydrogène
entre
bases
entassées
dans la
structure du
polymère
ont pour
effet de diminuer
l'absorption
de la
lumière
ultraviolette
par rapport
à une
solution ayant
la même
concentration
de
nucléotides
libres. C'est
l'hypochromicité
des acides
nucléiques.
Elle est
supérieure
pour l'ADN que
pour l'ARN. La
double
chaîne
de
désoxyribonucléotides
de l'ADN est
associée
par des
liaisons
hydrogène
entre A et T
(deux liaisons
hydrogène)
et C et G
(trois
liaisons
hydrogène),
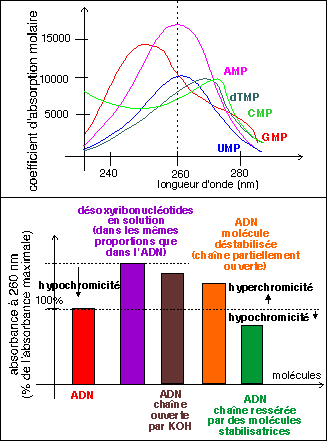
Hypochromicité
et
hyperchromicité
des acides
nucléiques,
une mesure du
degré
d'appariemment
des
chaînes
de
nucléotides...
On peut aussi
mesurer des
différences
d'absorption
en
fonction de
l'ouverture de
la
chaîne
d'ADN. Une
destruction
complète
des liaisons
hydrogène
peut
être
réalisée
avec de la
potasse (KOH
à 0,1N)
et les
deux
chaînes
de
nucléotides
se
séparent
au
maximum. On
observe alors
une hyperchromicité
(maximale) de
45 à
55% par
rapport
à la
valeur normale
de la
chromicité
de l'ADN sous
sa forme
ressérée.
D'autres
molécules
sont capables
de
déstabiliser
l'ADN et
d'ouvrir la
chaîne.
On peut
mesurer leur
efficacité
en chiffrant
l'hyperchromicité
de
l'ADN en
présence
de ces
molécules.
De la
même
façon,
certaine
molécules
stabilisatrices
ressèrent
l'ADN est
produisent une
hypochromicité.
retour
plan de la
page
5.Du
test d'Ames
à
l'Oncotest
Jusqu'au
début
des
années
70, le pouvoir
cancérogène
des substances
est
évalué
à
partir
d'essais sur
l'animal. Mais
les
extrapolations
à
l'homme sont
très
peu fiables.
5.1 Le test
d'Ames mesure
le taux de
réversion
de souches
bactériennes
mutagènes
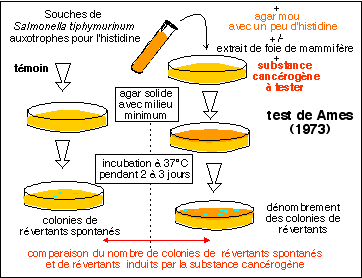
Décrit
par Bruce Ames
en 1973, le test
d'Ames
reste
très
employé
pour
évaluer
le pouvoir
cancérigène
d'une
substance. Il
est
basé
sur
le taux de
réversion
(mutation
permettant un
retour
à une
capacité
présente
dans la souche
sauvage)
de souches de
Salmonella
typhimurinum
, chacune
ayant une
mutation
différente
mais touchant
toute la
biosynthèse
de l'histidine
(souches auxotrophes
vis-à-vis
de
l'histidine),
un acide
aminé
habituellemnt
non
indispensable.
Les
bactéries
ont aussi des
modifications
de
leur paroi qui
les rendent
plus ou moins
perméables
aux
substances
analysées.
Enfin, les
bactéries
sont
défiscientes
dans leur
système
de
réparation
de
l'ADN par
excision et
possèdent
des
gènes
plasmidiques
favorisant un
fort taux de
mutation lors
de la
réparation
de
l'ADN. On
cherche
l'apparition
de souches
mutantes .
Pour s'assurer
que la
réplication
de l'ADN
puisse se
faire en
présence
du
mutagène
potentiel, les
bactéries
et la
substance
analysée
sont
mélangées
dans de l'agar
mou
auquel on
ajoute de
faibles
quantité
d'histidine.
Cet agar mou
est ensuite
étalé
à la
surface de
boîtes
d'agar
réalisées
avec un milieu
minimum. Les
boîtes
sont
incubées
2 à 3
jours à
37°C. Les
cellules
auxotrophes
pour
l'histidine
pousseront
quelques
heures
jusqu'à
épuisement
de l'histidine
du
milieu d'agar
mou. Seules
les
révertants,
ayant
retrouvé
la
capacité
à
synthétiser
de
l'histidine,
seront ensuite
capables de se
développer
sur
milieu
minimum. Les
colonies sont
ensuite
dénombrées
et
la valeur
obtenue sera
comparés
à un
témoin
afin
d'estimer le
pouvoir
mutagène
relatif de la
substance
vis-à-vis
de ces souches
auxotrophes
pour
l'histidine.
En plus
de la
substance
à
tester un extrait
de foie de
mammifère
(fraction
microsomale)
est souvent
ajouté
à
l'agar mou
avant
étalement.
Cet extrait
enzymatique
convertirait
les substances
cancérogènes
en
dérivés
électrophiles,
plus
susceptibles
de
réagir
directement
avec l'ADN,
système
absent chez
les
bactéries
mais
présent
chez les
mammifères.
Ainsi de
nombreux
agents
cancérogènes
comme les
aflatoxines ne
deviennent
actifs dans ce
test qu'en
présence
de cet extrait
de foie. On
considère
alors que la
comparaison
du test avec
et sans
extrait permet
de distinguer
les substances
nécessitant
une indiction.
Les critiques
majeures
concernant ce
test
concernent:
- son
inefficacité
pour environ
20% des
substances
cancérogènes,
d'après
ce que l'on
évalue
par d'autres
tests (ce
chiffre a
été
avancé
par
Ames
lui-même),
qui n'ont pas
d'effet
mutagène
sur ces
souches
bactériennes
auxotrophes
à
l'histidine,
- sa
limitation
à de
l'ADN
bactérien,
in vivo, ce
qui
impose des
facteurs non
contrôlables
de
pénétration
des
mutagènes
à
travers la
paroi et leur
non
inactivation
par le
métabolisme
bactérien,
- enfin le
postulat sur
lequel repose
la
méthode
qui est que
la
cancérisation
est une
mutation de
l'ADN, ce qui
n'est pas
prouvé.
La mutation
reverse des
auxotrophes de
l'histidine,
n'étant
par ailleurs
qu'une
mutation,
fréquente,
mais
pas non plus
aussi
universelle
qu'elle puisse
servir de
marqueur
absolu du
pouvoir
mutagène.
5.2
L'Oncotest
mesure
l'intensité
de la
réplication
de l'ADN de
cellules
cancéreuses
et saines
M. Beljanski
a mis au point
vers 1976
(publié
en 1978: M.
Beljanski, Oncotest
: A DNA assay
system for the
screening of
carcinogenic
substances,
IRCS Medical
Science, 1979,
7, p 476) un
test qui n'a
pas ces
inconvénients
et qu'il a
apellé
l'Oncotest.
En voici les
caractéristiques(Beljanski,
un novateur en
biomédecine;
concepts,
théories,
applications;
C.-G. NORDAU
et M.S.
BELJANSKI,
éd. EVI
Liberty Corp,
2001, p
36-39):
- il est
basé
sur le
postulat
radicalement
différent
de
celui sur
lequel repose
le test
d'Ames: les
substances
cancérigènes
cancérigènes
stimulent
fortement la réplication
de l'ADN
cancéreux
alors qu'elle
stimulent
très
faiblement la
réplication
de
l'ADN des
cellules non
cancéreuses;
- il
opère in
vitro sur
des ADN
purifiés
d'origine
humaine
(biopsies et
prélèvements
peropératoires)
d'organes
sains
(poumon, sein,
ovaire,
cerveau) et
d'organes
cancéreux
correspondants
sont
incubés
dans des
conditions
identiques. Le
test
fonctionne
aussi avec les
ADN des
souches
bactériennes
auxotrophes du
test de Ames.
Le milieu
contient un
désoxyribonucléotide-5'-triphosphate
marqué
à la
thymidine
tritiée
(dont
l'incorporation
à
l'ADN
nouvellement
synthétisé
permet de
suivre
l'intensité
de la
réplication),
et une ADN
polymérase
ADN
dépendante
extraite d'E.
coli qui
utilise l'ADN
humain fourni
comme matrice.
- il teste non
les
potentialités
de
mutagénèse
d'un
ADN
bactérien
instable (test
d'Ames) mais
l'action d'une
substance sur
la replication
de l'ADN de
cellules
humaines,
saines et
cancéreuses:
les produits
cancérigènes
ayant
toujours une
action
stimulante sur
la replication
de l'ADN des
cellules
cancéreuses
et non sur
celui des
cellules
saines. La
sensibilité
de l'oncotest
est excellente
et
détecte
un
centième
de microgramme
d'aflatoxine
B1, dangereux
cancérogène
pouvant
provoquer des
cancers du
foie.
Presque toutes
les
molécules
anticancéreuses
utilisées
en
chimiothérapie
sont à
forte dose de
puissants
cancérogènes,
ce que le test
d'Ames
indiquait
déjà
pour de
nombreux
produits. Les
hormones
stéroïdes,
qui ne donnent
pas de
réponse
au test
d'Ames,
peuvent,
à des
doses
supérieures
aux doses
physiologiques,
se comporter
comme des
cancérogènes,
spécifiques
de leurs
tissus cibles
(seins et
ovaires). Mais
l'oncotest
peut aussi
chiffrer la
toxicité
de substances,
non
cancéreuses,
sur la
replication de
l'ADN. Dans ce
cas la
toxicité
est
pratiquement
la même
aussi bien
pour l'ADN
issu des
cellules
cancéreuses
que celui issu
des cellules
saines:
l'action de
l'ADN
polymérase
est
inhibée
et la
réplication
est
stoppée.
certaines
substances,
comme la
saccharine
pure et le
cholestérol
sont neutres
vis-à-vis
de l'oncotest.
- l'oncotest
peut
être
utilisé
en recherche
pour la mise
au point
d'anticancéreux
spécifiques.
- dans
certains cas,
l'oncotest a
donné
des
réponses
positives pour
des substances
considérées
comme
dépourvues
de
potentialités
cancérogènes,
ce
qui a conduit
à
détecter
des
impuretés,
en
quantité
infimes mais
dangereuses,
dans les
extraits.
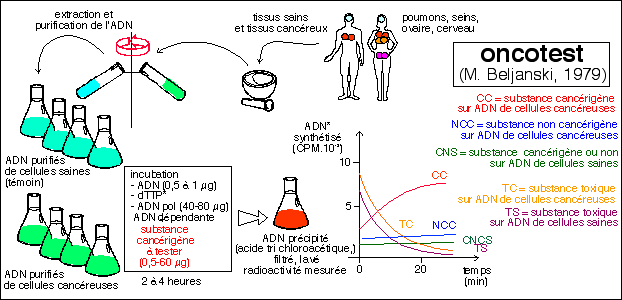
Une
illustration
de l'oncotest
à
partir d'une
description
sommaire dans
Beljanski,
un novateur en
biomédecine;
concepts,
théories,
applications;
C.-G. NORDAU
et M.S.
BELJANSKI,
éd. EVI
Liberty Corp,
2001 sans
avoir eu
accès
à la
publication
originale (M.
Beljanski,
Oncotest :
A DNA assay
system for the
screening of
carcinogenic
substances,
IRCS Medical
Science, 1979,
7, p 476)
retour
plan de la
page




