Les roches
retour accueil
concepts, formulations
par cycle, expériences
1. Concepts
Le texte ci-dessous est repris de
l'aide-mémoire destiné aux
terminales et adapté aux
élèves-professeurs des écoles.
Qu'est-ce qu'une roche ?
3 approches menant à 3 définitions
complémentaires:
A quoi ça sert ?
Une roche est fondamentalement un matériau de
l'écorce terrestre.
C'est cette approche pratique, utilitariste ou technique qui est
développée en cycles1 et 2. Une roche est un
matériau exploité pour construire des routes, des
maisons, des objets... (voir niveaux de
formulation).
De quoi est-ce fait ?
Une roche est un habituellement un solide
composé d'un assemblage de minéraux.
Certaines roches peuvent cependant être liquides
(pétrole) ou gazeuses (gaz naturel).
Pour un géologue c'est un caillou, et le terme n'a rien de
péjoratif. L'étude des roches est la
pétrographie (du latin petrus = pierre).
Un minéral est un assemblage d'atomes ordonnés
formant une espèce chimique naturelle. Pour un naturaliste, un
beau minéral est un solide bien cristallisé (un
cristal), même si un minéral refroidi trop vite
donne un verre amorphe non cristallisé. L'étude des
roches est la minéralogie qui fait appel à la
cristallographie et à la cristallochimie.
Cette approche peut être réalisée avec les
enfants dès le cycle 2 et poursuivie au cycle 3 dans le
cadre de la connaissance de la matière (voir niveaux
de formulation et expériences).
D'où viennent les roches ?
C'est une toute autre approche, beaucoup plus conceptuelle et qui
ne peut être réalisée qu'au cycle 3,
même si les termes définis ici peuvent être
employés beaucoup plus tôt. Lorsqu'on s'intéresse
aux conditions de formation des roches on fait appel à une
compréhension globale des mécanismes
géologiques.
L'origine des roches nous permet de les classer classiquement en
trois groupes:
- roches sédimentaires issues d'un
sédiment
- roches magmatiques, issues d'un magma
- roche métamorphique, issue d'une autre roche
(sédimentaire ou magmatique)
a - les roches sédimentaires
Les roches sédimentaires sont issues d'un
sédiment par diagénèse. Les
sédiments se déposent dans les bassins
sédimentaires (et donc dans l'eau de mer), sauf
quelques sédiments lacustres (de lacs non salés) ou
franchement terrestres (éboulis, sédiments glaciaires
comme le loess...). Un sédiment est une accumulation
d'éléments d'origine biologique, minérale
et chimique. Le sédiment est un milieu de vie, il comporte
encore une grande quantité d'eau. Au cours de la
diagénèse (augmentation de la pression et de la
température par enfouissement), l'eau est expulsée et
la vie se raréfie. Les roches semblent contenir des
bactéries ("Les micro-organismes de l'intérieur du
Globe", James Fredrickson et Tullis Onstott, La Recherche, 230,
décembre 1996), même jusqu'à 2,8
kilomètres de profondeur.
- les éléments d'origine biologique
(squelettes, coquilles, tests, fragments de
végétaux....) et de la précipitation par les
organismes vivants d'éléments chimiques (calcaire et
silice essentiellement) semblent être présents dans
toutes les roches sédimentaires.
- les éléments minéraux issus de la
dégradation d'autres roches (éléments
détritiques) par l'érosion essentiellement et
accumulés dans les bassins à la suite de leur
transport par les fleuves peuvent être en plus ou moins
grande quantité. Des éléments minéraux
d'origine volcanique explosive (pyroclastique ou
volcanosédimentaire) comme des cendres peuvent aussi
former des couches sédimentaires très
épaisses ou se mélanger à des particules
d'autres origines.
- les éléments de précipitation chimique
pure forment parfois de grandes accumulations exploitées
par l'homme (mines de roches nommées
évaporites car issues de l'évaporation de
l'eau de mer comme par exemple le sel de mer : chlorure de sodium
(NaCl ou halite) ou le gypse...).
Une roches sédimentaire est souvent un mélange
d'éléments de différentes tailles et de
différentes origines, ce qui fait que les classifications sont
variées. Chacune, mettant l'accent sur quelques
propriétés, est utilisée par tel ou tel
spécialiste. Nous n'en donnerons aucune.
|
Sédiment
|
Roche sédimentaire
|
|
nom de la roche
|
minéraux
|
|
sable calcaire
|
calcaire
dolomie
calcaire oolithique (formé de petites
concrétions sphériques probablement d'origine
bactérienne en milieu agité: plage des
Bahamas... notre prochain voyage d'études de
spécialité)
|
calcite ou aragonite (CaCO3),
dolomite (Ca,Mg)CO3) par remplacement
partiel du Ca dans la calcite
|
|
sable siliceux
|
grès (roche solide),
sable (roche meuble)
|
quartz (SiO2)
|
|
sable coquiller
|
calcaire coquiller
|
calcite (CaCO3)
|
|
sable calcaire avec beaucoup d'argile ("vase" ou
boue)
|
marne (35 à 65% d'argile) calcaire marneux
(- de 35% d'argile)
|
argiles (Si,AL, Fe, Mg SiOx)
calcite (CaCO3)
|
|
argile (vase ou boue)
|
pélite (argilite, siltite...)
|
argiles (Si,AL, Fe, Mg SiOx)
|
|
boue calcaire (boue carbonatée)
(au-dessus de la CCD: profondeur de
compensation de la calcite: Calcite Compensation
Depth)
|
calcaire fin
calcaire lithographique (grains
très fins, utilisé dans l'imprimerie
autrefois)
|
argiles (Si,AL, Fe, Mg SiOx)
calcite (CaCO3)
|
|
boue siliceuse des très grands fonds
(au-dessous de la CCD et en dessous de la
SCD: Silice Compensation Depth)
|
radiolarite, jaspe
|
quartz, calcédoine, opale (SiO2)
|
|
boues à Diatomées (petits algues
unicellulaires enfermées dans un frustule
ornementé) lacustre ou océanique des grands
fonds
|
diatomite
|
quartz, calcédoine, opale (SiO2)
|
|
galets pris dans un ciment plus fin, sableux ou
argileux
|
conglomérat : poudingue
(éléments arrondis) ou brèche
(éléments anguleux)
|
....
|
|
éléments pyroclastiques (cendres
(Ø<2mm), lapillis(2<Ø<66mm),
blocs(Ø>66mm))
|
avec les mêmes limites de taille
des éléments:
cinérites, tufs, brèches
volcaniques
|
|
b - les roches magmatiques
Les roches magmatiques sont issues d'un magma. Elle
peuvent avoir refroidi lentement et en profondeur,
elles sont alors bien cristallisées (on parle de roches
cristallines): ce sont les roches plutoniques. Ou bien
elles peuvent aussi s'être écoulées ou avoir
projetées par explosion en surface et donner ainsi des
roches volcaniques en coulées (plus liquides) ou en
amas, pitons ou cheminées (laves plus visqueuses), ou en
dépôts de cendres ou autres produits de plus grande
taille (cendres< lapillis<bombes). Les roches volcaniques
cristallisent plus rapidement que les roches plutoniques et
possèdent souvent de cristaux de moins grande taille
(l'expérience la plus simple réalisable
dès le cycle 2 est la cristallisation de la vanilline - voir
expériences).
Certaines roches volcaniques solidifiées trop vite n'ont pas
cristallisé et donnent des verres (roches vitreuses).
Quelques roches magmatiques :
roches plutoniques et roches
volcaniques
|
|
pôle alcalin (Na, K)... roche claire et
visqueuse
|
pôle
saturé (acide)
très riche en silice
|
|
Avec du quartz
(SiO2)
|
Sans quartz
|
pôle
sous-saturé
moins riche en silice
|
|
roches à minéraux CLAIRS abondants
|
Feldspaths alcalins (K) et
Plagioclases sodiques (Na)
|
granodiorite
rhyo-dacite
|
syénite
trachyte
|
|
granite
rhyolite
|
diorite
andésite
|
|
Plagioclases calciques
(Ca)
|
gabbro quartzique
basalte tholéitique
|
gabbro
basalte
|
|
roches à minéraux SOMBRES dominants
|
Amphibolites,
Pyroxénolites,
Péridotites
|
|
pôle basique (Ca, Mg, Fe)... roche sombre et
fluide
|
c - les roches métamorphiques
Les roches métamorphiques sont issues soit de roches
sédimentaires (roches paramétamorphiques), soit
de roches magmatiques (roches orthométamorphiques),
soit encore de roches déja métamorphisées
(roches polymétamorphiques). Le domaine du
métamorphisme dans lequel les roches subissent donc un
métamorphisme, c'est-à-dire une transformation à
l'état solide, se situe entre le gradient géothermique
le plus faible (6 °C par kilomètre) et le solidus du
granite hydraté (apparition du magma).
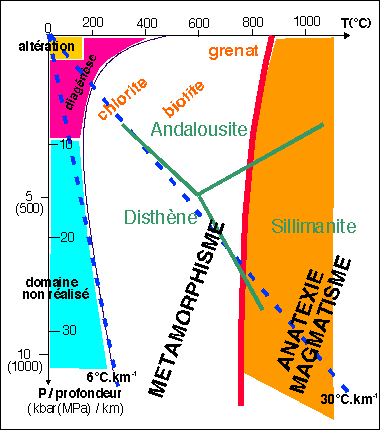
Position du métamorphisme dans un diagramme P, T.
(en pointillés bleu : les géothermes de gradient
6°C.Km-1 et 30°C.Km-1- en rouge: le
solidus du granite hydraté - en vert : les silicates d'alumine
(coordonnées du point triple= 5Kbar - 600°C) - en orange
: quelques minéraux marqueurs du
métamorphisme).
Il est rare que l'on puisse déterminer si une roche
métamorphique vient de la transformation de telle ou telle
roche (roche d'origine) à telle ou telle pression et
température (trajet en P, T de la roche, c'est-à-dire
son histoire métamorphique). Les noms des roches
métamorphiques sont donc souvent assez généraux.
Ils sont précisés en ajoutant le nom de minéraux
marqueurs qui peuvent être visibles soit sur
l'échantillon à l'œil nu soit sur une lame mince.
Voici quelques noms que vous ne pouvez ignorer:
|
Quelques roches
métamorphiques..
|
Quelques minéraux du
métamorphisme
|
|
schiste
|
toute roche métamorphique présentant une
schistosité c'est-à-dire des plans de
débitage donnant un aspect feuilleté à
la roche
|
minéraux argileux:
séricite, chlorite, biotite
autres minéraux marqueurs:
grenat, staurotide...
silicates d'alumine
de formule : (SiAl2O5):
sillimanite, andalousite,
disthène
|
|
micaschiste
|
roche métamorphique présentant une
schistosité et une foliation
(schistosité minéralogique correspondant
à des accumulations de minéraux le longs de
plans). Riche en lamelles de micas (brillantes) visibles
à l'œil nu.
|
|
gneiss
|
roche métamorphique à foliation très
nette caractérisée par des alternances de lits
de teinte sombre (riches en minéraux
ferromagnésiens) et de lits clairs (quartz et
feldspaths).
|
|
marbre
|
roche métamorphique calcaire à grains fins
présentant ou non des veines colorées
correspondant à différents minéraux
argileux. Proviennent de calcaires ou dolomies.
|
|
amphibolite pyroxénite
|
roches métamorphiques sombres où dominent
les amphiboles ou les pyroxènes. Elles peuvent
provenir d'argiles sédimentaires, de basaltes ou
encore de gabbros.
|
2. Formulations par cycle
La géologie semble être cantonnée au cycle
3 (volcans, séismes et évolution) mais il est clair que
les questions sur la terre et le monde minéral débutent
bien avant: d'où le travail ci-dessous pour vous aider
à formuler les concepts vus ci-dessus.
|
Cycle 1
|
Cycle 2
|
Cycle 3
|
|
Les roches sont les matières non
vivantes qui constituent la terre. Les cailloux, les
rochers, mais aussi le sable, sont des roches plus ou moins
transformées par la pluie, le vent ou la mer. Les
roches sont souvent recouvertes de terre, qui forme le
sol, et dans laquelle de nombreux petits êtres
vivants vivent. Les roches forment le sous-sol.
|
Une roche est un matériau naturel
terrestre.
De nombreuses roches sont transformées par l'homme
pour servir de matériaux dans la construction
ou les travaux publics : sables et graviers, granites,
calcaires, marbres, craies ....exploitées dans des
carrières. Il existe des roches très
particulières composées de matière
organique morte enfouie profondément : le
pétrole (un liquide plus ou moins visqueux), le gaz
naturel (un gaz) et le charbon (un solide)
|
Une roche est un matériau naturel
terrestre composé habituellement de
minéraux: elle est habituellement solide mais
peut être peut être liquide (pétrole) ou
gazeuse (gaz naturel). Une roche solide peut être dure
(granite) ou moins dure (argile). Une roche solide peut
être cohérente (calcaire) ou meuble
(sable)(voir
séismes -
annexe).
Selon leur origine on distingue:
* les roches sédimentaires issues de la
solidification et de la mort des êtres vivants d'un
sédiment
* les roches magmatiques issues de la solidification
d'un magma (roche en fusion venant de l'intérieur de
la terre au niveau d'une zone appelée le manteau et
située à plus de 150 km de profondeur). Si le
magma refroidit et solidifie en profondeur il donne des
roches plutoniques comme le granite ou le gabbro. Si
le magma arrive en surface il provoque une
éruption volcanique qui produit des gaz et des
roches en fusion qui donneront en se solidifiant des
roches volcaniques.
* les roches métamorphiques sont issues de la
transformation des roches sédimentaires et
magmatiques lorsqu'elles sont enfouies sous terre (elles
sont chauffées et pressées et perdent de
l'eau).
Un minéral est définit comme le
composant de base des roches (comme les cellules composent
les êtres vivants). Le granite est composé de 3
principaux minéraux : le quartz, un feldspath et un
ou des micas comme la biotite.
Un minéral est un solide composé d'une
espèce chimique d'habitude organisée en
assemblage très ordonné que l'on appel un
cristal.(expérience a)
Quand un magma en fusion refroidit lentement les cristaux
bien ordonnés on le temps de se former et les
minéraux sont tous présents sous forme de
cristaux comme dans le granite où tous les
minéraux sont visibles à l'œil nu. Les
roches plutoniques, refroidies lentement sont souvent bien
cristallisées (roches "cristallines").
Quand un magma en fusion refroidit vite par exemple si une
lave arrive au fond d'un océan où l'eau de mer
est à une température de 2°C, la lave est
"trempée" et les cristaux n'ont pas tous bien le
temps de se former comme dans un basalte: l'olivine, qui est
le premier minéral à se former, cristallise
bien et est souvent visible à l'œil nu, mais par
contre les feldspath ou les micas forment des cristaux tout
petits ou mal ordonnés qui ne sont pas visibles
à l'œil nu. Les roches volcaniques, refroidies
plus vite que les roches plutoniques, sont souvent mal
cristallisées et peu de minéraux sont visibles
à l'œil nu.
|
3. Expériences
La géologie demande beaucoup de travail
et on dit facilement des bêtises. Il est cependant certain que
les approches par la réalisation d'expériences et de
montages divers sont très riches si l'on reste bien conscient
que l'on est pas dans le champ
expérimental (au sens strict de
méthode expérimentale) mais dans le domaine du
modèle. Mon côté
géologue me fait dire que l'on devrait plutôt leur faire
toucher des cailloux, leur montrer sur le terrain des volcans, des
plis, des failles, et leur présenter les modèles
ensuite. Mais pourtant le travail sur de la confiture, du beurre ou
de la pâte à modeler est réellement efficace. Je
pense donc qu'il faut faire les deux, de façon
indissociable.
a - cristaux - cristallisation
|
Expériences - modèles
|
Concepts abordés -
interprétation
|
|
Placer une saumure très surchargée en sel
de cuisine (une cuillère à soupe d'eau pour
une de sel fin de cuisine) dans une coupelle de verre Pyrex.
Chauffer (sous le TRIDACT). On voit se former les cristaux
de NaCl (le nom du minéral est la halite) qui
cristallisent dans le système cubique. A la loupe
binoculaire les cristaux sont encore mieux visibles.
Si vous êtes patients, placez cette saumure sur le
dessus d'un radiateur en hiver ou devant une fenêtre
au soleil en été. Les cristaux sont cette fois
millimétriques et bien visibles à l'œil
nu.
|
La notion de cristal comme élément interne
est illustrée par le fait de trouver le même
forme pour tous les cristaux d'une même espèce
chimique, même si le cube n'est pas
complètement formé pour tous les cristaux qui
n'ont pas tous la possibilité de croître de
façon régulière (la saumure n'est pas
homogène, ni le chauffage... et les parois
interviennent aussi dans les mécanismes de
nucléation, qui est l'apparition du noyau, "germe" du
cristal qui croît ensuite plus ou moins
régulièrement selon les disponibilités
en atomes....).
Une expérience plus
intéressante par ses applications économiques
est l'évaporation de l'eau de mer dans les marais
salants par exemple. On voit alors que la halite n'est pas
le premier sel à précipiter même s'il
représente la masse principale (précipitent
d'abord du carbonate de calcium et du gypse). Pour des
données sur l'évaporation de l'eau de mer,
voir page sur les carbonates.
(La terre, 50 expériences pour découvrir
notre planète, André Prost, p 78-79,
Belin, 1999)
|
|
Des petites billes des plastique sont placées dans
un carré de grand côté sur la surface du
rétroprojecteur (ou visualisé en grand
grâce au TRIDACT): on visualise leur dispersion.
On diminue l'espace disponible en rapprochant petit à
petit les côtés : on observe le rangement
progressif des billes qui finissent par s'immobiliser.
|
dans un cristal les atomes sont ordonnés, ils
perdent des degrés de liberté. La formation
d'un cristal demande du temps.
|
|
La vanilline est un produit organique (naturel ou
synthétique) que l'on trouve en pharmacie (ou dans
les catalogues de produits chimiques) sous forme de poudre
(société rachetée par
Rhône-Poulenc donc très cher): 65,80F les 25g
(suffisant pour plusieurs années de TP) et qui
après avoir été fondu sur une lame
au-dessus d'une bougie (quelques grains de poudre
suffisent), recristallisent en quelques minutes à
l'air libre et à la température ambiante en
formant d'abord de belles mâcles (parfois) puis des
cristaux radiaires assez joli (surtout en lumière
polarisée). La même lame, placée sur un
glaçon donne plus vite, des tout petits cristaux.
|
La vitesse de cristallisation (plus élevée
à froid qu'à température ambiante) et
la taille des cristaux (polycristaux à froid et mono
ou bi-cristaux à la température ambiante) en
fonction de la température est un premier facteur
observable de façon qualitative.
La présence de mâcles est facilement
observable au sein des gouttes moyennes (mâcles par
interpénétration de 2 cristaux
liée à la symétrie des arrangements
de ces molécules aromatiques: l'angle qu'ils font est
inférieur à 45°).
Enfin, on peut suivre au microscope les étapes
progressives (accroissement exponentiel) de la
cristallisation en temps réel.
La vanilline est un composé organique
cyclique (composé aromatique en
C6C1) qui dérive par
ß-oxydation de l'acide cinnamique (corps en
C6C3 synthétisé chez les
végétaux à partir des acides
aminés aromatiques: tryptophane et
phénylalanine) qui donne aussi l'acide
salicylique (présent notamment dans certains
fruits de Rosacées et voisin de l'aspirine: l'acide
acétylsalicylique), l'acide gentisique (de la
Gentiane) ou l'aldéhyde anisique (de l'Anis)
ou encore le salicoside (du Saule) (voir figure
ci-dessous).
Les lois de l'empilement régulier des
atomes dans les cristaux minéraux semblent être
les mêmes pour les molécules dans les
cristaux organiques. Il est aisé de
relier le nombre de germes (cristallite ou grain ou
premier tout petit cristal à apparaître)
à la taille des cristaux obtenus: pour un liquide
parent donné, plus il y a de germes, moins les
cristaux seront de grande taille (on obtient un
polycristal). Pour avoir un mono-cristal il faut avoir un
seul germe. Pour la vanilline il semble qu'il y ait
essentiellement des polycristaux sauf pour les toutes
petites gouttes de liquide. On peut noter que si l'on fait
fondre un cristal de grande taille il faut attendre plus
longtemps à même température (et donc
fournir une énergie calorifique plus grande) que pour
faire fondre les petits cristaux de la poudre
industrielle.
On peut aussi signaler l'intérêt que la
chimie indutrielle organique porte aux solides (parfois peu
cristallins car mal ordonnés) que sont les
polymères naturels comme la soie, le coton, le
collagène ou la kératine ou
synthéthiques comme le nylon ou le
polyéthylène.; mais l'unité du principe
d'arrangement ordonné de molécules identiques
est important à souligner.
|
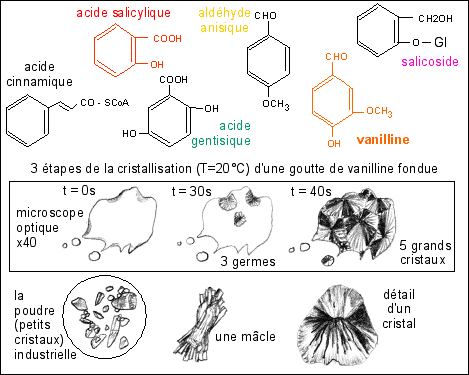
Remarque: On notera que, dans le dessin présentant la
cristallisation de la grande goutte, les petites gouttes ne
sont pas encore cristallisées au bout de 40 s (une
seule l'est); en effet, la cristallisation de ces petites
gouttes peut intervenir nettement plus tard (plusieurs
minutes): plus la goutte est grande et épaisse, plus
la cristallisation est rapide.
|
b - états de la matière :
solide-liquide-gazeux
On est sans cesse confronté à la structure de la
matière et aux niveaux de formulation souhaitables selon les
cycles: voici quelques exemples soutenus par des expériences
simples:
L'eau liquide coule et mouille.
La glace est de l'eau solide. Lorsque de l'eau gèle il y a
passage d'un liquide à un solide (solidification). La
glace qui fond passe de l'état solide à l'état
liquide (liquéfaction ou fusion).
L'air est un gaz invisible qui nous entoure.
La vapeur d'eau est aussi un gaz invisible. Elle vient de l'eau qui
passe de l'état liquide à l'état gazeux
(vaporisation). Le nuage de "vapeur d'eau" au-dessus d'une
casserole d'eau bouillante est en fait un nuage d'eau (voir page sur
l'air).
Les nuages sont de l'eau ou de la glace qui tombent en pluie (eau
liquide) ou en petits cristaux étoilés (neige) ou en
petits glaçons (grêle).
La rosée qui se dépose au matin sur les feuilles et les
tiges est de l'eau qui passe de l'état gazeux (vapeur d'eau
invisible dans l'air) à l'état liquide (goutte de
rosée). Le passage de l'état gazeux à
l'état liquide est la condensation. Si tu sors une
bouteille du réfrigérateur et que tu la laisses
à l'air libre la vapeur d'eau de l'air se condense en fines
gouttelettes à sa surface.
Ces changements d'états sont facilement observables avec le
TRIDACT en prenant le temps de bien observer chaque étape et
de laisser les changements avoir lieu : lame de verre avec
gouttelettes d'eau, évaporation de l'eau; témoin avec
cloche et condensation de l'eau évaporée....
Une image (d'après Yves Quéré, Les
matériaux, Graines de science, Editions Le Pommier, 1999) : la
matière est composée d'une myriade de petits grains
élémentaires: les molécules. Pour l'eau
qui est un corps simple toutes les molécules sont identiques :
la molécule d'eau est elle même composée d'atomes
(a privatif signifie donc non et tomo vient du grec couper : donc les
atomes ne peuvent pas être coupés; mais depuis le
début du XIXème siècle où la philosophie
atomiste des grecs a été rejointe par les
théories scientifiques expérimentales de Dalton, on
connaît bien d'autres particules composant les atomes) : 2
atomes d'hydrogène pour un atome d'oxygène pour
l'eau.
Une image simple : si les grains d'un sable fin
représentent les molécules, l'état
liquide serait le sable fluide, qui coule entre les doigts;
l'état solide serait un sable compacté et durci
après la pluie et l'état gazeux, le sable
transporté par le vent ou une poignée jetée en
l'air dont les grains se dispersent.
c. roches
|
Expériences - modèles
|
Concepts abordés -
interprétation
|
|
Fabriquer des hydrocarbures
On peut réaliser dans un aquarium un début
de dégradation de la matière organique qui
conduise à la formation d'hydrocarbures (en fait on
fabrique du kérogène: matière
organique formée de chaînes d'hydrocarbures, de
graisses et de divers produits organiques non encore
dégradés).
Au fond de l'aquarium sont placés des
débris végétaux (couche de 10 cm)
tassés et recouverts d'eau. Une couche d'argile pure
d'au moins 2 cm d'épaisseur doit isoler la masse de
végétaux en décomposition de l'air. Une
couche d'eau est ajoutée par-dessus. L'ensemble est
placé dans une pièce sombre et non
aérée. Des odeurs nauséabondes se
dégagent (bulles) et des irisations
(kérogène) apparaissent dans l'eau.
|
(La terre, 50 expériences pour
découvrir notre planète, André
Prost, p 80-81, Belin, 1999)
Le système est concu pour être à
l'abri de l'air et donc pour que les organismes
(bactéries) anaérobies (qui ne
nécessitent pas la présence d'air pour se
développer) se développent. Le gaz produit est
essentiellement du méthane (CH4, qui peut être
mis en évidence par son inflammation dans l'air -
grâce à la présence de dioxygène
auquel il se combine) et un peu d'hydrogène sulfureux
(H2S: odeur d'œuf pourri).
Il est évident que ce système n'a pas la
richesse du milieu naturel où les réactions
sont beaucoup plus complexes et nécessitent un temps
beaucoup plus long. De plus les accumulations de
matière organique ne sont pas des volumes libres
comme dans le modèle réalisé mais le
kérogène occupe les interstices d'une roche
porteuse. Les pressions atteintes liées à
l'enfouissement modifient aussi les réactions
chimiques.
Les feux follets sont des exhalaisons de phosphure
d'hydrogène s'enflammant spontanément à
l'air. Ce gaz étant produit dans des milieux plus
riches en dioxygène que ceux qui sont favorables aux
hydrocarbures (marais, tourbières...).
|
retour accueil
concepts, formulations
par cycle, expériences

