l'eau
retour accueil, défisciences
2000-2001: "dans l'air du temps", hydrogéologie,
lumière
Un incontournable pour les esprits curieux: L'eau
dans la cellule, une interface hétérogène et
dynamique des macromolécules, Pascale Mentré, Masson,
1995
Un dossier spécial récent sur l'eau assez peu riche :
L'or bleu, Pour la Science, 282, avril 2001, p
27-50
Un n° spécial plus ancien mais tellement plus riche:
L'eau, La Recherche, 221, mai 1990
Physiologie animale; adaptation et milieux de vie, Knut
SCHMIDT-NIELSEN, Dunod, 1998
Encyclopedia Universalis
Ce thème était celui du défisciences 1999-2000.
Voici quelques données scientifiques éparses qui seront
complétées au cours de cette année 2001.
Qu'est-ce que l'eau ?
Une substance, un liquide, un gaz, un solide, une molécule,
un corps pur.... c'est tout cela à la fois mais pas
forcément en même temps pour le même observateur.
Le premier point de vue sera donc celui du physicien: on
étudie l'eau comme corps pur, c'est l'eau
idéale, l'eau concept.
L'eau est aussi un élément naturel qui, à
l'état liquide et solide recouvre plus des 2/3 de la surface
de la terre et est contenue dans l'atmosphère (pour une
très faible part en masse: 0,03%). C'est un
élément qui est spécifique à la terre,
non pas parceque l'on n'en trouve que sur terre mais parceque c'est
bien elle qui, pour ce que l'on sait jusqu'à maintenant, en
possède le plus et à l'état liquide. Ce
deuxième point de vue est celui du "bio-géologue
environnemental" ou encore"bio-géo-écologue", une
spécialité qui n'existe pas vraiment et dont l'objet
est l'ensemble des eaux naturelles, qui feront l'objet du
deuxième chapitre.
C'est encore un élément nécessaire à
la vie que l'on retrouve à 70-80% dans le corps humain et dans
tous les êtres vivants. Ces eaux biologiques feront
l'objet de la troisième partie.
Du fait de son caractère nécessaire à la vie,
l'eau est toujours été pour l'homme un symbole
(eau germinale et fécondante, eau médicale, eau
baptismale ou lustrale ou encore eau diluviale selon les
catégories proposées par Gilbert Durand, in E.U.
article "symbolisme des eaux"). Ce point de vue, pourtant tout aussi
essentiel que le point de vue scientifique expérimental, ne
sera pas traité ici.
Sommaire de cette page:
1. l'eau pure
1.1 l'eau est une molécule
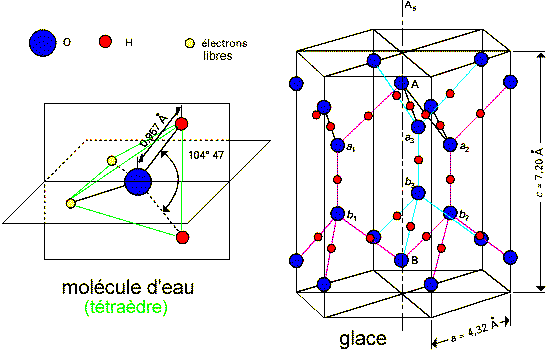
Figures d'après l'E.U.
La molécule d'eau est un dipôle, les deux
extrêmités correspondant aux atomes d'hydrogène
étant chargées positivement et le côté
correspondant à l'atome d'oxygène étant
chargé négativement. Le moment dipôlaire
élevé (1,85 debye) est expliqué par
l'existence de deux paires d'électrons libres. Les
molécules d'eau sont associées entre elles aussi bien
en phase liquide (la structure précise de l'eau liquide n'est
pas élucidée mais on pense qu'il existe des lacunes
dans lesquelles les ions sont piégés: on peut parler de
la structure cristalline de l'eau) qu'en phase solide (la glace dont
le cristal est représenté sur la figure de droite mais
il en existe au moins dix formes cristallines). La polarité de
la molécule d'eau est aussi responsable de la polarité
de l'eau comme solvant.
Il existe plusieurs variétés isotopiques
d'eau moléculaire qui sont des compositions faites avec l'un
ou l'autres des trois isotopes des deux composants de la
molécule:
|
isotopes de l'hydrogène
(% dans l'eau de mer actuelle)
|
1H protium
(99,984%)
|
2H deuterium
(0,016%)
|
3H tritium
(traces%)
|
|
isotopes de l'oxygène
(% dans l'eau de mer actuelle)
|
16O
(99,76%)
|
17O
(0,04%)
|
18O
(0,20%)
|
La composition isotopique de l'eau de certains réservoirs
comme les eaux météoriques est différente de
celle d'autres réservoirs comme les glaces polaires ou l'eau
de mer, ce qui fait que l'on peut, grâce à cette
signature isotopique, suivre parfois leur cheminement à
la surface du globe. On peut même parfois reconstituer
l'histoire de certaines eaux souterraines. L'utilisation des isotopes
de l'oxygène pour l'étude des
paléoclimats a été abordée en
terminale S, spécialité: le
quaternaire.
retour sommaire
1.2 l'eau dans tous ses états
La terre est la seule planète du système solaire
à posséder une température et une pression de
surface permettant à l'eau de se présenter sous trois
états: solide (glace ou neige mais aussi les hydrates),
liquide et gazeux (vapeur d'eau).
Dans le tableau de Mendeleiv (classification périodique des
éléments la plus courante) l'oxygène devrait
être à la pression atmosphérique et à la
température ordinaire (25°C) un gaz (il suffit de voir sa
position entre l'azote et le fluor). Or c'est un liquide. De plus ce
liquide se vaporise à des températures très
élevées (100°C pour un composé aussi
léger c'est beaucoup; à comparer avec la
température d'ébullition de l'azote:
-195,7 °C) ). De même il se solidifie à haute
température (0°C à comparer avec les
températures de fusion de l'azote: -210 °C). Ces
valeurs sont sans conteste dues aux liaisons hydrogène qui
s'établissent entre molécules d'eau à
l'état liquide et lui confèrent ainsi une structure des
plus originales.
Le premier graphe incontourable est donc le diagramme de phases de
l'eau qui est a lui seul très original:
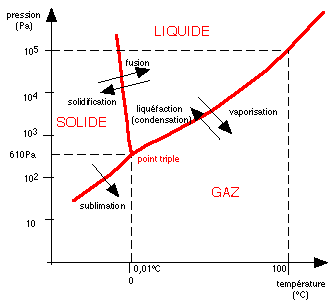
Le diagramme de phase de l'eau (assez peu précis). On notera
principalement la pente négative de la courbe de
transition de phase solide-liquide (voir plus bas : c'est la raison
pour laquelle une même masse de glace occupe plus de volume que
de l'eau liquide à même pression) et la position du
point triple de la glace ordinaire de type Ih (0,01°C et 610
Pa) qui est un point fixe de l'échelle internationale des
températures. A la pression atmosphérique (101.325 Pa)
l'eau liquide bout (1ère bulle de gaz produite) à
100°C. Ce sont d'ailleurs les températures de la glace
fondante et de la vapeur condensante (sous la pression
atmosphérique normale de 101.325 Pa) qui définissent le
0 et le 100 de l'échelle Celsius.
Le minéral glace peut prendre dix formes
cristallines, dont une seule, la glace Ih, se forme
naturellement sur la Terre. La symétrie
hexagonale du réseau cristallin de cette
variété est évidente lorsqu'on examine un
cristal de neige, formé dans l'atmosphère
à partir de la vapeur d'eau. La propriété la
plus remarquable de la glace Ih, et la plus importante du point
de vue écologique, est d'être moins dense que le liquide
correspondant (l'eau), à la différence des autres
corps. Sous des pressions supérieures à
200 mégapascals se forment des glaces
«normales», c'est-à-dire plus denses que l'eau sous
la même pression, baptisées glace II à
glace IX. Sous de faibles pressions, mais à la
température de l'hydrogène liquide, on peut obtenir une
glace Ic, cubique, et aussi, par trempe de gouttelettes
microscopiques d'eau, de la glace amorphe, non
cristallisée.
A l'école primaire il est ce me semble
préférable de remplacer le diagramme ci-dessus par un
petit organigramme présentant les relations entre les 3 phases
de l'eau.
Les 3 phases de l'eau et les noms des changements de phase
retour sommaire
1.3 Propriétés
physiques
L'eau présente certaines anomalies par rapport
à d'autres corps purs:
* elle se contracte à la fusion
(pente négative de la courbe de fusion); et donc elle augmente
de volume à la solidification (la bouteille d'eau au
congélateur éclate). Si on
augmente la pression exercée sur de la glace, elle
fond, ce qui est une propriété vraiment
originale.
* elle a une densité maximale à
3,98 °C. Au-delà, son coefficient de
dilatation est important.
Ce qui fait qu'à 0°C la glace
solide flotte sur l'eau liquide, pour la plus grande joie des
patineurs.
* sa compressibilité est faible.
* son enthalpie de vaporisation donne une constante de Trouton
anormale, voisine de 26. (Cette constante, quotient de la chaleur
molaire de vaporisation par la température absolue
d'ébullition, est l'entropie molaire de vaporisation. Elle est
de 21 pour la plupart des substances.)
* sa chaleur spécifique entre 14,5 et 15,5 °C a
servi à définir la calorie, qui est la
quantité de chaleur nécessaire pour faire parcourir
un tel échauffement à un gramme d'eau. Elle
décroît au-delà et passe par un minimum au
voisinage de 35 °C.
La viscosité de l'eau est relativement faible (sa
fluidité est forte) et si on la comprime sa viscosité
diminue (la fluidité augmente, ce qui est contraire aux
principes habituels). Sa conductibilité thermique est
quinze fois plus petite que celle du mercure. C'est un liquide
très mouillant (tension superficielle )
vis-à-vis du verre, qu'il recouvre parfaitement d'une mince
pellicule avec un angle de raccordement pratiquement nul (voir
bulles). Ce sont les forces
intermoléculaires (dues essentiellement aux liaisons
hydrogène) qui expliquent la tension superficielle et la
viscosité de l'eau anormalement élevées pour une
molécule de petite taille.
L'eau liquide est transparente sous faible
épaisseur, bleue sous grande épaisseur. Opaque
dans l'infrarouge, c'est un filtre calorifique. Sous
1 centimètre, elle absorbe toutes les longueurs d'onde
supérieures à 1,4 mm. Son absorption dans
l'ultraviolet est importante vers 186 nanomètres.
Sa constante diélectrique est l'une des plus
élevées. La conductivité
électrique de l'eau ultra-purifiée est très
faible : l'eau conduit mal les électrons alors qu'elle conduit
très bien les protons, ce qui est pour le moins
étonnant vu la masse respective de ces éléments
(la masse de l'électron est près de 2000 fois plus
petite que celle de l'atome d'hydrogène qui est le plus petit
des atomes). Mais il est vrai qu'il ne faut pas oublier que ces
conductions se font ... sans déplacement de
matière.
retour sommaire
1.4 Propriétés
chimiques
A l'état gazeux, l'eau est très stable : la
vapeur d'eau est très peu dissociée, même
à température élevée (2% à
2 000 °C, 60 % à
3 000 °C).
A l'état liquide, l'eau est ionisée (se
dissocie en ions). Dans une eau pure la concentration en ions
H+(H3O+) est égale à
celle des ions OH- est a pour valeur 10-7
ion-g/L.
Les propriétés oxydo-réductrices de l'eau
peuvent être déduites de deux réactions:
2H2O + 2e- ----> H2 +
2OH- (E°=-0,83V)
2H2O ----> O2 + 4H+ + 4e-
(E°=+1,23V)
Le diagramme potentiel d'oxydo-réduction-pH
(voir plus bas dans cette page) rend compte
des conditions nécessaires pour électrolyser l'eau (ddp
minimale de 1,23V) et des zones où agissent les oxydants de
l'eau (comme le fluor F2 -> F2O + F-: E°F-/F=+1,9V) ou ses
réducteurs (comme le sodium: Na -> Na OH: E°Na/Na+ =
-2,71V).
L'eau, polaire et de grande constante diélectrique, mauvais
solvant des composés non polaires (hydrocarbures), est
un bon solvant des composés à liaisons H et des
électrolytes. Les sels, solutés ioniques, ont des
solubilités très variées: 360 grammes par
kilogramme d'eau pour le chlorure de sodium, 110 grammes pour le
sulfate de potassium et seulement 0,7.10-3 g pour le
sulfure de zinc. Les ions tels que La3+, Mg2+,
H+, OH- et F- («formateurs de
structures», analogie avec la formation d'«icebergs»)
servent de noyaux pour la formation d'essaims; il y a accroissement
de l'ordre dans l'eau. Les ions comme K+, Na+,
ClO4-, I-, NO3-, qui sont
hydratés par une seule couche de molécules d'eau,
inhibent la formation d'essaims: ce sont des «briseurs de
structures» (Franck). La mesure de l'hydratation des ions montre
que les premiers sont fortement hydratés. En solution
diluée, H+ est tétrahydraté (ion
H9O4+ de Eigen). Les solutions
concentrées en acide contiennent l'ion
H3O+; l'ion H+ libre n'existe
pas.
retour sommaire
1.5 Hydrates: des minéraux contenant
de l'eau... solide
L'eau solide est également
présente dans d'innombrables minéraux, les
hydrates naturels.
Par exemple dans CuCl2, 4 H2O le cation (Cu+) est
entouré partiellement d'anions (Cl-) et partiellement de
molécules d'eau. Dans d'autres hydrates comme NiSO4,
7 H2O le cation est entièrement entouré
d'eau et des molécules d'eau supplémentaires raccordent
par liaisons H le cation hydraté aux anions.
L'eau donne des hydrates de gaz avec l'argon, le
méthane, l'hémioxyde d'azote, le dioxyde de carbone,
etc. L'hydrate de chlore dit à 6 molécules d'eau
qui en est le prototype est en réalité à
5,75 H2O. L'eau y prend une configuration
spéciale et forme des cages qui piègent
les petites molécules: 46 H2O groupées
piègent 8 Cl2 ou 8 Ar, etc., 136 H2O
groupées autrement piègent 16 molécules de
chloroforme (hydrates à 17 H2O, ). Linus
Pauling a expliqué l'action
anesthésique de composés tels que
l'oxyde nitreux, le dioxyde de carbone et le chloroforme ainsi
que des gaz rares (agents non formateurs de liaisons H) par la
cristallisation de leurs hydrates. Les microcristaux formés
abaissent la conductivité électrique du réseau
nerveux. Il y a diminution concomitante de l'énergie des
oscillations électriques qui caractérisent
l'état conscient et, de ce fait, perte de connaissance. C'est
aussi de cette façon que l'on pourrait expliquer l'hibernation
(formation de cristaux d'hydrates de gaz par diminution de la
température).
Les zéolites naturels ou artificiels sont des
alumino-silicates formant des cages dans lesquelles l'eau est
piégée. Par exemple le zéolite
Na12[(AlO2)12(SiO2)12]
peut capter 27 H2O qu'il perd progressivement quand
la température augmente.
retour sommaire
2. les eaux naturelles : l'eau pure
n'existe pas
2.1 des eaux naturelles
Les eaux naturelles sont des mélanges, l'oxyde
d'hydrogène étant souillé par des
impuretés minérales (notamment bien sûr les gaz
dissous comme le dioxygène et le dioxydede carbone) ou
organiques.
Le deuxième diagramme, non moins incontournable que le
diagramme de phases de l'eau, mais moins connu et plus difficile
d'accès est celui des potentiels rédox et de pH.
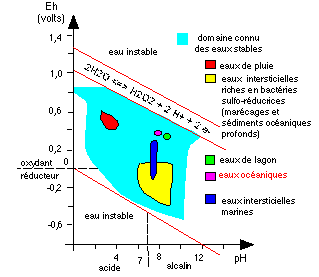
Diagramme des potentiel rédox (Eh) et de pH de l'eau
(d'après Comprendre et enseigner la
planète terre, Ophrys, 1989, p 152).
Eh est une mesure de la concentration des électrons en
solution (en Volts). le pH est une mesure de la concentration en
protons (ion hydrogène ou H+ ou plutôt H3O+) en solution
(en unités pH). Les domaines des différentes eaux sont
donc caractérisés par des potentiels
rédox-différents et un pH différent ce qui
explique la solubilité des autres ions dans ces eaux et donc
leur comportement dans l'altération ou la précipitation
de tel ou tel sel.
Dans les domaines instables de l'eau, les éléments
chimiques oxydent ou réduisent l'eau.
La qualité d'une eau est caractérisée par sa
dureté rapportée à la teneur en carbonate
de calcium. Actuellement on dispose souvent d'une analyse
minérale complète des eaux de consommation
courante.
retour sommaire
2.2 les précipitations: bruine,
pluies, neige, glace, grésil, grêle, givre
Les précipitations sont généralement issues
des nuages et des brouillards, eux-mêmes
constitués de microgouttelettes d'eau ou de glace dont les
dimensions s'échelonnent de quelques micromètres
à 20 ou 30 micromètres au maximum (pour une
densité de plusieurs dizaines à quelques centaines par
centimètre cube), selon la nature et l'âge du nuage. Les
gouttelettes des nuages et brouillards tombent si lentement par
gravité que ce mouvement descendant est négligeable par
rapport aux mouvements des masses d'air saturé auxquelles
elles appartiennent du moins tant qu'elles se trouvent en
équilibre de tension de vapeur avec le milieu ambiant.
Mais lorsque la taille atteinte par les gouttelettes est de l'ordre
de 50 micromètres, la précipitation devient
perceptible et prend le nom de bruine si elle est à
l'état liquide. Ce n'est qu'au-delà de ce seuil
d'environ 50 micromètres que les précipitations se
font sous forme de pluie, avec un spectre de dimensions allant
de quelques dixièmes de millimètre à un maximum
de 4 ou 5 mm pour certaines pluies d'orage ou d'averse.
Lorsque la température de l'air est inférieure à
0°C, les précipitations se présentent initialement
sous forme de microcristaux, puis de flocons de neige, ou de
neige roulée, quelquefois sous l'aspect de sphérules de
grésil (d'un diamètre de l'ordre du
millimètre), et enfin, mais rarement, sous forme de
grêle. Le poids et les dimensions du grêlon sont
extrêmement variables: inférieurs au gramme pour les
plus modestes, les poids atteignent parfois quelques centaines de
grammes dans des conditions exceptionnelles.
Enfin, le sol et la végétation peuvent recevoir un
poids important d'eau transformée en glace dans des situations
à givrage sévère. Il ne s'agit pas
là de précipitations au sens formel du mot; il y a
seulement augmentation du volume de gouttelettes de glace
déjà présentes par condensation de vapeur d'eau
venant de l'atmosphère.
* Par passer de l'état dynamique "d'eau en suspension dans
une masse d'air" à une "précipitation", la condensation
simple est insuffisante - tout comme le recours aux collisions entre
gouttes qui semblent être plutôt élastiques-
à rendre compte d'accroissements de 10 à 100 du
diamètre des gouttelettes soit de 1000 à 1.000.000 de
leur masse. Le premier mécanisme invoqué le fut par Tor
Bergeron en 1936 : pour des nuages froids (en-dessous de l'isotherme
0°C), les noyaux de condensation proposés seraient
des cristaux de glace qui grandiraient brusquement par apport
d'eau (sous forme vapeur) depuis des gouttelettes en surfusion
voisines; une fois leur chute initiée ils captureraient
d'autres microgouttelettes qui se solidifieraient à leur
contact. Si en cours de chute la goutte de glace traverse l'isotherme
0°C elle fond et se transforme en goutte de pluie. Pour les
nuages chauds, Henri Dessens, en 1947, a proposé un
mécanisme similaire à partir de très gros noyaux
de condensation, formés de chlorure de
sodium, et pouvant atteindre des dimensions de l'ordre
du micromètre. Ces particules salines, provenant de la
dessiccation des microgouttelettes d'embruns arrachés à
la mer, se rencontrent effectivement dans les masses d'air maritime,
même à grande distance des côtes au-dessus des
continents. Sur ces noyaux hygroscopiques géants, la
condensation dans une première phase amènera la
déliquescence, puis la dissolution de la particule de sel.
Tant que la dilution ne sera pas trop forte la goutte d'eau
salée augmentera de taille par transfert de vapeur d'eau et
condensation. Si le point de déséquilibre est atteint
(quelques dizaines de micromètres) la chute commence et la
goutte d'eau salée peut capturer d'autres gouttes et
croître au fur et à mesure de sa chute. Enfin, Irving
Langmuir proposa une théorie des processus de capture en
chaîne lorsque, dans un nuage, s'amorce une
hétérogénéité dans une population
de microgouttelettes. En calculant le coefficient de captation sur la
trajectoire d'une gouttelette de vitesse de chute notable dans une
atmosphère nuageuse, il démontra que les captures par
impactions (conséquences d'un impact non élastique)
successives pouvaient devenir rapidement significatives et amener la
formation de grosses gouttes de pluie.
Certaines précipitations peuvent s'évaporer à
nouveau avant d'atteindre le sol, surtout lorsque la base du nuage
est à une altitude élevée. Ce
phénomène est relativement courant à certaines
saisons, et ces précipitations prennent alors le nom de
virgae .
* La grêle est un phénomène mal connu et
très combattu dans toutes les régions du monde en
raison de ses effets dévastateurs sur les récoltes. De
plus, la grêle est un phénomène capricieux :
présente chaque année ou presque dans certaines
régions, elle est rarissime ailleurs. Des grêlons ou
amas de grêlons dépassant le kilogramme ont parfois
été signalés. Les mécanismes
thermodynamiques de formation de la grêle commencent à
être suffisamment connus; en revanche, le ou les schémas
de la structure du cumulo-nimbus susceptible de donner naissance
à de la grêle sont encore assez hypothétiques.
Dans un nuage type cumulo-nimbus à grand développement
vertical, il existe des cellules où de véritables
cheminées de plusieurs centaines de mètres de
diamètre amènent en altitude l'air humide et chaud
provenant des basses couches, et cela avec des vitesses pouvant
atteindre et dépasser 30 m/s. Dans ces régions du
nuage, la turbulence, les noyaux hygroscopiques et le
mécanisme de Langmuir se relaient et s'unissent pour aboutir
à la formation de la pluie. Mais, compte tenu des vitesses
d'ascendance, toute l'eau liquide condensée en gouttelettes,
puis rassemblée en gouttes de pluie, continue son ascension
relative, car les plus grandes vitesses de chute pour les très
grosses gouttes ne dépassent jamais 9 m/s. On doit donc
observer une véritable accumulation d'eau en altitude.
Effectivement, les radars indiquent toujours des échos
très intenses, «suspendus» en altitude dans les
nuages à grêle. Au fur et à mesure que cette
accumulation d'éléments précipitants atteint des
températures suffisamment négatives, la glaciation
apparaît. Dans une première phase, la goutte de pluie se
congèle en altitude et présente vraisemblablement
l'aspect d'un grain de grésil. Le mécanisme de Bergeron
et les captures mécaniques interviennent ensuite pour
édifier couche par couche autour du germe initial les
structures du grêlon. Cette croissance peut être
relativement rapide: l'impact des éléments de nuage et
de pluie par le grêlon au cours de sa chute se traduit par un
coefficient de captation élevé compte tenu des vitesses
relatives de ces éléments, mais l'eau en surfusion
ainsi captée ne s'intègre pas obligatoirement au
grêlon dans sa totalité, car la chaleur latente de
solidification ramène le bilan thermique à des valeurs
voisines de 0 °C; l'excès d'eau non congelée
s'échappe alors dans le sillage du grêlon sous forme de
gouttelettes.
Comme les vitesses verticales d'ascendance sont
élevées, les grêlons resteront en altitude
jusqu'à ce que leur vitesse de chute propre devienne
supérieure à celle de l'air dans les cheminées
d'ascendance où ils se sont formés. C'est alors que la
chute de grêle commence à se produire effectivement, et
l'arrivée au sol se fera avec des vitesses d'impact
considérables, fonctions du poids et du facteur de forme du
grêlon, élément déterminant le coefficient
de traînée.
Ce schéma simplifié ne permet pas d'expliquer pourquoi
la grêle n'est pas un phénomène beaucoup plus
fréquent; des accumulations d'eau en altitude sont souvent
clairement détectables au radar sans que pour cela des chutes
de grêle soient observées. Il semble qu'une faible
concentration en noyaux glaçogènes naturels efficaces
soit une des conditions de la formation de la grêle et qu'un
certain schéma dans la répartition des courants
ascendants doive être en même temps
réalisé.
La première de ces hypothèses a bien entendu
incité tous ceux qui essaient de lutter contre la grêle
à agir le plus simplement du monde en introduisant des noyaux
glaçogènes artificiels au sein ou à la base du
nuage.
* Pluies sans nuage, rosée et givrage
Le serein , qui ne saurait être mieux défini que
par l'expression «pluie sans nuages», est un
phénomène également assez rare se
présentant surtout l'été ou dans les
régions tropicales en air maritime. Si l'on admet que le
spectre des noyaux de condensation présente parfois une
répartition anormalement élevée de noyaux
hygroscopiques géants par rapport à une population de
noyaux moins efficaces, on peut comprendre que seuls les premiers
commenceront à utiliser la phase vapeur disponible et que,
dans ces conditions, tant que la concurrence des autres noyaux n'est
pas intervenue, seuls les «noyaux géants»
prélèveront l'eau disponible dans l'atmosphère.
La croissance peut ainsi être très rapide, et des
gouttes assez larges mais peu nombreuses parviennent au sol sans
qu'il y ait de nuages visibles, sinon parfois de place en place. En
altitude, dans les régions équatoriales, ce
phénomène se trahit par la formation d'un
arc-en-ciel dans un ciel pratiquement sans nuage, mais sans que
les précipitations puissent en général atteindre
le sol.
Enfin, les apports d'eau atmosphérique au sol peuvent provenir
de phénomènes très superficiels comme la
rosée , qui n'est pas une précipitation (voir
ci-dessous), ou le givrage , en montagne ou dans les mers
polaires, qui correspond bien en revanche à un apport d'eau
par un nuage, en partie dû à des
phénomènes de transfert par l'intermédiaire de
la phase vapeur et en partie par captures directes des
éléments en surfusion des nuages ou brouillards, ce qui
est par définition un type particulier de
précipitation.
* Pour mesurer le volume et la densité des
précipitations sur une surface donnée, on utilise
classiquement des pluviomètres, récipients
calibrés avec une ouverture franche de diamètre
standard, à une hauteur sandard et éloigné de
tout relief, bâtiment ou végétation
perturbateurs. Mais on utilise aussi les radars, très
efficaces pour déterminer le type de précipitation, les
masses d'eau cachées dans des nuages (notamment les nuages
à grêle)...
*On ne sait pas faire tomber l'eau d'un nuage si les gouttelettes
n'en ont pas la matûrité. On ensemence ainsi des nuages
avec des noyaux de condensation (il semblerait que l'on puisse ainsi
atteindre des améliorations de l'ordre de 10% du volume de
précipitation en comparaant des zones ensemencées et
non ensemmencées d'un même nuage). La lutte contre la
grêle reste très aléatoire même si le
principe reste le même : apporter des noyaux
glaçogènes complémentaires.
Il faut bien noter qu'un nuage, une fois formé, ne demeure pas
un système statique mais évolue sans cesse. En
particulier, lorsque des conditions naturelles suffisantes sont
réalisées pour que les précipitations puissent
prendre naissance, la pluie ne «vide» pas le nuage de son
contenu en eau condensée disponible. Seul un faible
pourcentage, 10% parfois, de cette eau condensée atteindra le
sol. En revanche, la continuité de la pluie est due aux
mécanismes naturels d'entretien du nuage lui-même. Pour
chaque type de nuage, une «durée de vie»
donnée est en général prévisible et les
hauteurs totales de pluie atteignant le sol dépendent à
la fois de l'intensité des précipitations et de la
persistance des mécanismes d'entretien. Un nuage se forme,
passe par une période de maturité compatible ou non
avec l'apparition de précipitations, puis disparaît par
réévaporation des gouttelettes qui le constituent.
C'est seulement au cours de la phase de maturité qu'une action
de l'homme a des chances de réussir, mais seulement lorsque
les conditions naturelles régissant les processus de
précipitation sont déjà pratiquement
réalisées.
Remarque:
la rosée n'est pas une précipitation mais une
condensation dirigée par les végétaux:
elle se traduit par des gouttelettes d'eau perlant aux feuilles et
aux tiges des arbustes, décorant la végétation
au voisinage du sol, c'est donc un phénomène biologique
(du au refroidissement de la végétation par un air
froid stagnant au niveau du sol (par nuit claire (sans nuages) qui
permet au sol de rayonner et de se refroidir), ce qui
nécessite aussi une absence de vent qui brasserait
l'atmosphère. La température de la
végétation passe alors au-dessous du point de
rosée (température pour laquelle la vapeur d'eau
présente dans l'atmosphère a atteint la pression
saturante) et condense à sa surface, sous forme de
gouttelettes, la vapeur d'eau disponible dans l'atmosphère
ambiante. Après les premières heures d'insolation,
l'échauffement direct du sol et de la
végétation, et la turbulence qui en résulte
échauffent l'air des basses couches et revaporisent la
rosée formée la nuit ou aux premières heures du
matin.
retour sommaire
2.3 exploitation et protection des eaux
de surface
Les eaux de surface sont en équilibre avec les
précipitations (voir plus haut) et les infiltrations: les
aspects hydrogéologiques sont traités dans une
page spéciale.
Une eau claire n'est pas
forcément propre, même si une eau trouble est
souvent polluée.
(Le terme de pollution (souillure) en
écologie moderne désigne la dégradation d'un
milieu naturel à la suites de la contamination par des agents
toxiques (essentiellement liés à la production
d'énergie, aux activités industrielles et à
l'agriculture). Pollution fait référence à une
vision écologique (centrée sur l'habitat) et non
anthropocentrique comme le fait le terme de nuisance. Et
pourtant la limite est parfois floue: nuisances sonores, nuisances
esthétiques, olfactives, gustatives... pour lesquelles la
santé n'est pas directement mise en danger.)
De même, une eau qui contient des
êtres vivants n'est pas forcément propre
(notamment pas consommable) car certains êtres vivants (larves
d'insectes notammen) supportent des eaux très polluées
et les bactéries sont
présentes dans TOUTES les eaux naturelles.
Sur le terrain la qualité d'une eau peut être
évaluée par ce qu'on appelle l'indice biotique
calculé à partir du dénombrement
d'espèces d'invertébrés qui ont des exigences
différentes vis-à-vis essentiellement du
dioxygène disponible. La quantité de dioxygène
dépendant aussi essentiellement de la quantité de
microorganismes aérobies, eux-mêmes dépendant de
la quantité de matière organique disponible. Une eau
ayant un indice biotique inférieur à 5 est
considérée comme polluée.
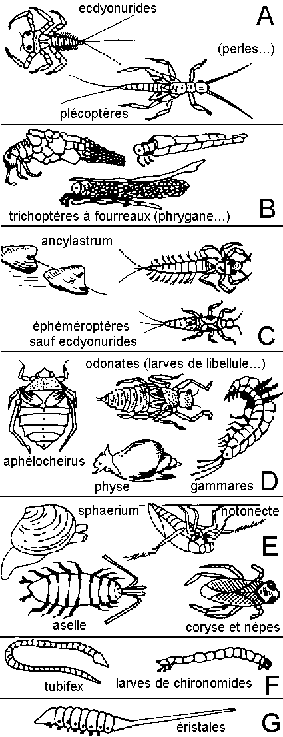
d'après La vie et la terre, 2nde, Istra,
1987, p 261
groupes faunistiques
(sensibilité décroissante à la
pollution organique)
|
nombre d'unités systématiques
dans le prélèvement
|
pour
A, B et C
|
nombre total d'unités
systématiques
|
|
1
|
2 à 5
|
6 à 10
|
11 à 15
|
16 ou plus de 16
|
|
A
|
>1
|
valeur des indices
biotiques
|
|
|
7
|
8
|
9
|
10
|
|
1
|
5
|
6
|
7
|
8
|
9
|
|
B
|
>1
|
|
6
|
7
|
8
|
9
|
|
1
|
5
|
5
|
6
|
7
|
8
|
|
C
|
> 2
|
|
5
|
6
|
7
|
8
|
|
¾ 2
|
3
|
4
|
5
|
6
|
7
|
|
D
|
|
3
|
4
|
5
|
6
|
7
|
|
E
|
2
|
3
|
4
|
5
|
|
|
F
|
1
|
2
|
3
|
|
|
|
G
|
0
|
1
|
1
|
|
|
Une unité systématique est habituellement une
espèce (ou un genre ou un ordre ou une famille selon les cas);
le nombre d'unités systématiques est à bien
séparer du nombre d'individus récoltés
appartenant à une même unité systématique
(par exemple 3 larves de libellule, appartenant donc à la
même unité systématique: larves d'odonates).
Exemples: 8 individus trichoptères à fourreaux
identiques (même unité systématique) donnent un
indice biotique de 5; 8 trichoptères à fourreau
appartenant à 3 genres différents donnent un indice de
6; 8 trichoptères à fourreaux appartenant à 8
genres différents donnent un indice biotique de 7...
En laboratoire la qualité d'une eau peut aussi être
mesurée en référence au dioxygène mais
cette fois on mesure
* la quantité de dioxygène consommée par les
organismes (DBO: demande biologique d'oxygène) pendant
un temps donné (habituellement 5 jours, on parle alors de
DBO5) ou
* la quantité de dioxygène consommée lors de
l'oxydation de la matière organique (DCO: demande chimique
d'oxygène) et autres substances oxydables présentes
dans l'eau.
On réalise aussi bien sûr des mesures de pH, des
comptages de bactéries (surtout les
entérobactéries, souvent pathogènes, dont la
plus connue est Escherichia coli).
|
paramètres mesurés
|
niveaux de qualité de l'eau
|
1A
(très bonne)
|
seuils
|
1B
(bonne)
|
seuils
|
2
(moyenne)
|
seuils
|
3
(mauvaise)
|
seuils
|
4C
(très mauvaise)
|
MES (mg.L-1)
matière en suspension
|
valeurs inférieures aux seuils de la colonne
de droite
|
.
|
valeurs comprises entre les deux colonnes
latérales
|
25
|
valeurs comprises entre les deux colonnes
latérales
|
70
|
valeurs comprises entre les deux colonnes
latérales
|
150
|
valeurs supérieures aux seuils de la colonne
de gauche
|
DCO (mgO2.L-1)
demande chimique en (di)oxygène
|
20
|
25
|
40
|
80
|
DBO5 (mgO2.L-1)
demande biologique en (di)oxygène
|
3
|
5
|
10
|
25
|
|
NH4+
(mg.L-1)
|
0,1
|
0,5
|
2
|
8
|
|
NO2-
(mg.L-1)
|
0,1
|
0,3
|
1
|
2
|
|
NO3-
(mg.L-1)
|
|
|
50
|
100
|
|
SO42-
(mg.L-1)
|
|
|
250
|
|
|
Cl- (mg.L-1)
|
100
|
20
|
400
|
1000
|
|
O2dissous (mg.L-1)
|
7
|
5
|
3
|
|
|
saturation en O2 (%)
|
90
|
70
|
50
|
|
|
chlorophylle (mg.m-3)
|
10
|
60
|
120
|
300
|
|
|
1A
(très bonne)
|
|
1B
(bonne)
|
|
2
(moyenne)
|
|
3
(mauvaise)
|
|
4C
(très mauvaise)
|
d'après SVT, 2nde, Calamand, Hachette,
1997, p 206
Dans la nature on observe une auto-épuration des
eaux c'est-à-dire la capacité pour les eaux naturelles
donc habitées d'oxyder des quantités assez
importantes de matière organique polluante rejetées par
les activités humaines. Le renouvellement des masses d'eau
libres facilite cette auto-épuration. Les mesures de DBO et de
DCO sont une bonne approximation des capacités
d'auto-épuration d'une eau naturelle: il n'est pas rare
qu'à l'arrivée dans une station d'épuration on
atteigne des valeurs de 270 mgO2.L-1 pour la
DBO et de 340 mgO2.L-1 pour la DCO.
Dans certains cas (renouvellement faible ou apport trop important de
matière organique) l'autoépuration est insuffisante et
on observe un excès de matière organique qui conduit
rapidement au développement de microorganismes aérobies
qui consomment du dioxygène (essentiellement des
bactéries, notamment les cyanophycées ou
bactéries bleues...). Comme l'eau est un milieu pauvre en
dioxygène (voir les valeurs dans la page
sur l'air), ce qui est surtout vrai pour les couches profondes
dont le dioxygène se renouvelle lentement (coefficient de
diffusion faible), l'oxygène se raréfie et les
organismes qui nécessitent une eau riche en dioxygène
meurent (l'indice biotique de l'eau diminue fortement, voir
ci-dessus). Il s'agit dans ce cas de pollution.
Dans les milieux naturels on a l'habitude de considérer deux
stades possibles:
* l'eutrophisation (du grec eu = bien et
trophê= nourriture) qui désigne un
appauvrissement en dioxygène des couches profondes dû
à un apport NATUREL excédentaire
d'éléments minéraux, favorisant le
développement des producteurs primaires (unicellulaires et
bactéries chlorophylliens) et donc par conséquent un
excédant de matière organique.
* la dystrophisation (du grec dys, dus =
difficulté, mauvais état) indiquant un
déséquilibre d'origine humaine dans le
développement des producteurs primaires (phytoplancton mais
aussi plantes à fleurs dont la jacinthe d'eau ou les lentilles
d'eau sont des exemples classiques...). Dans le cas d'une pollution
il est donc préférable de parler
de dystrophie.
Dans les années 90 a été
réalisé par EDF-GDF un petit logiciel de simulation de
la gestion d'un lac qui présente des profils des principaux
nutriments et organismes vivants dans les eaux d'un lac au cours de
l'année, en fonction des prélèvements et des
rejets d'eaux usées. Il s'appelle "La vie du lac" et
est disponible gratuitement pour une plateforme PC. Je ne sais plus
s'il est diffusé mais j'en possède un exemplaire que je
peux aisément copier.
Le traitement collectif des eaux
usées
|
arrivée des eaux usées
|
traitement primaire
|
traitement secondaire
|
traitement tertiaire
|
départ des eaux épurées et rejet
dans le milieu naturel
|
|
dégrillage
|
désablage
|
déshuilage
|
décantation
|
floculation
|
clarification
|
|
les déchets les plus encombrants (canettes,
bouteilles de plastiques et autres déchets
ménagers, bois flottés, ...) sont retenus par
les barreaux d'une ou plusieurs grilles
|
dans une cuve profonde dont l'excédent d'eau
s'écoule par le dessus des parois latérales,
l'écoulement lent favorise la sédimentation
des matières lourdes comme les sables qui se
déposent au fond
|
dans une cuve aérée fortement les
matières légères (mousses et autres
émulsions...) flottent et sont
récupérées
|
les boues sédimentent lentement au fond d'une
grande cuve de décantation
|
on ajoute des substances floculantes (voir bulles)
qui favorisent la conversion des matières organiques
dissoutes et colloïdales (voir bulles)
en matières décantables c'est-à-dire
qui peuvent sédimenter au fond de la cuve
|
décantation des boues
|
décontamination bactérienne (ozonation ou
chloration) ou élimination de l'azote ou
élimination du phosphore
|
|
Les boues (comportant encore beaucoup d'eau)
récupérées dans les stations
d'épuration peuvent être directement
épandues (fertilisation des sols agricoles) ou subir
d'abord un séchage avant d'être
compostées, brûlées ou mises en
décharge.
|
Toutes les habitations ne peuvent être raccordées
à des stations d'épuration et on installe dans ce cas
un système d'épuration individuel. Dans un
terrain de surface suffisante, de bonne perméabilité et
de faible pente (ni eau stagnante, ni eau circulante) on recueille
les eaux usées contaminées dans une fosse septique
(avec éventuellement un bac de dégraissage
branché avant la fosse) qui réalise une
autoépuration essentiellement par des bactéries
anaérobies (fortement pathogènes pour la
plupart). Un bac de type "décolloïdeur"
précéde un système d'épandage individuel
formé par un ou plusieurs drains mis en place dans une
tranchée de filtration: ces drains épandent
progressivement les eaux sortant de la fosse septique et ce sont les
bactéries du sol, principalement aérobies, qui
réalisent alors l'auto-épuration finale (pour des
précisions sur la vie aérobie et
anaérobie, voir page
sur l'air).
Les usines de traitement pour l'eau potable ajoutent aux
dispositifs d'épuration une décantation
supplémentaire, une filtration sur lit de sable puis une
ozonation avant stockage et distribution.
retour sommaire
2.4 l'eau dans le cosmos
Parmi les planètes du système solaire la terre est
la seule à possèder de l'eau sous ses trois
états et notamment à l'état liquide.
Vénus possède de la vapeur d'eau dans son
atmosphère (0,01% d'eau, 96,5% de CO2, 3,5% d'N2, 0,02% de SO2
et des traces de gaz rares) très épaisse (>200 km),
très dense (90 fois la pression atmosphérique
terrestre) et très chaude (450°C à la surface de
la planète).
Mars possède de la vapeur d'eau en faible (et variable)
quantité dans son atmosphère (<0,03%) très
peu épaisse, froide (-50°C en surface) et de faible
densité (pression atmosphérique 10 fois moins
élevée que sur la terre); mais Mars possède
aussi des sols gelés qui contiendraient de l'eau sous forme de
glace.
Certaines comètes comme Titan, trop froides pour contenir
de l'eau liquide, renferment cependant de la glace et on peut penser
que dans des temps plus anciens de l'eau liquide a pu exister
à leur surface.
On pense aussi que de l'eau liquide a pu exister à la surface
de planètes ou de satellites de planètes du
système solaire qui aujourd'hui ne contiennent plus d'eau.
retour sommaire
3. les eaux biologiques = les eaux
des êtres vivants
|
l'eau
vivante
|
l'eau est le principal constituant de la
matière vivante; les biologistes ne
perçoivent plus la cellule vivante comme un
sac plein d'eau mais comme un milieu
gélifié très ordonné et
structuré par d'innombrables molécules
associées les unes aux autres en complexes et
transportées activement dans les différentes
parties de la cellule (et non pas disposées au hasard
et diffusant dans un milieu fluide) (voir schéma
ci-dessous)
|
|
l'eau
peuplée
|
l'eau est LE milieu de vie; toutes les eaux sont
peuplées... ou presque
|
|
l'eau porteuse et l'eau
motrice
|
l'eau est dense et donc porteuse mais elle
demande une grande énergie pour être mise en
mouvement
l'eau transporte et aide à la
dissémination et à la
fécondation de gamètes, zygotes et
larves de nombreux êtres vivants
|
|
l'eau
protectrice
|
l'eau change lentement et peu (avec une grande inertie)
de température : c'est donc un milieu de vie
protecteur vis-à-vis des écarts
thermiques
|
|
l'eau
sensible
|
l'eau pure n'existe pas; l'eau est pleine de
substances aux goûts variés; l'eau peut
être polluée; dans l'eau les organes des
sens ne sont pas les mêmes que dans l'air (voir,
entendre, goûter...)
|
|
l'eau
nourricière
|
respirer dans l'eau est plus difficile que dans
l'air
rejeter (excréter) de l'eau ou boire
?
dans l'air un être vivant a tendance à
perdre son eau; il lui faut économiser l'eau
et boire; la soif l'aide dans le contrôle de ses
besoins en eau.
Dans l'eau douce , un être vivant a tendance à
absorber trop d'eau, il doit donc en rejetter; par contre
dans l'eau de mer il perd de l'eau et donc doit boire sans
cesse pour compenser
|
|
l'eau berceau des roches
sédimentaires
|
les sédiments se déposent dans les
bassins sédimentaires. L'eau érode les
reliefs et entraîne les éléments
détritiques et chimiques en suspension ou en solution
dans l'eau vers les bassins sédimentaires. Le
dépôt des minéraux
sédimentaires se fait sous contrôle
biologique (bactérien, test des unicellulaires,
coquilles, squelettes...).
|
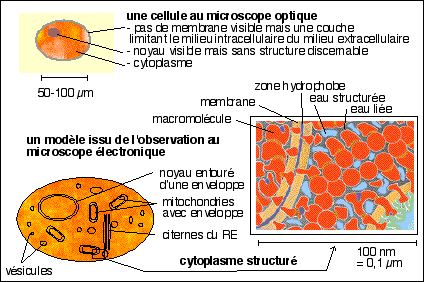
Un essai de représentation d'un modèle biologique d'une
cellule comme "complexe moléculaire structuré"
(le schéma du cytoplasme est extrait et
très modifié de Pascal Mentré, L'eau dans la
cellule, Masson, 1995)
retour sommaire
retour accueil, défisciences
"air", hydrogéologie,
lumière





