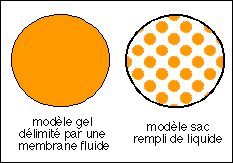
Deux modèles cellulaires... c'est celui de droite qui prédomine actuellement
Deux parties bien séparées au programme :
* les mécanismes ioniques à la base du potentiel de
repos et du potentiel d'action
* la biochimie de la transmission synaptique.
Au moins les sujets sont clairement défini.
Si on se contentait du titre du programme il n'y aurait aucun
problème. Mais il y a les cellules. A quelles cellules fait-on
référence ? Aux cellules nerveuses sans aucun doute.
Mais aussi à toutes les cellules excitables. Donc le sujet
concerne la théorie membranaire, actuellement
utilisée par la plupart des biologistes, expliquant les
variations de potentiel de la cellule par des courants ioniques
franchissant les membranes et régulés
sélectivement par des pompes ou des canaux intramembranaires
(cette théorie est citée dans les commentaires
officiels du programme). Cette
théorie se heurte à de nombreux problèmes non
résolus et il existe notamment d'autres théories comme
la théorie des phases élaborée dans les pays de
l'Est (voir Pascale Mentré). Comme l'élève de
terminale est avant tout un candidat au bac il est évident que
je présenterais d'abord la théorie membranaire, puis
les problèmes et une ouverture sur d'autres réponses.
Le deuxième problème vient bien évidemment de la
limite des compétences de l'enseignant (je ne suis pas tout
à l'aise avec toutes ces techniques et je ne suis certainement
pas le seul... ) : il est évident que l'effort de mise
à jour demandée par l'exposé de ces
théories relève parfois du défi pour un
bénéfice très restreint quand à la
formation de l'élève.
Depuis les premières observations de Hooke en 1955, puis de
De Vries (1884), la cellule végétale a d'abord
été comparée à un petit osmomètre
(avec sa vacuole centrale qui se remplit ou se vide comme on le fait
découvrir à nos élèves dès le
collège). La membrane plasmique étant inconnue on
pensait que c'était le protoplasme qui formait un gel
semi-perméable en laissant passer l'eau.
La mise en évidence de la membrane plasmique par microscopie
électronique à transmission (Palade,
Porter et Sjöstrand, 1952) fut précédée
par des études essentielles mais qu'il est trop long de
relater ici : certains auteurs parmi lesquels il est difficile de ne
pas citer Overton (vers 1900), à l'aide d'expériences
variées de pénétration de diverses substances
dans la cellule, déterminèrent les
propriétés de perméabilité de la cellule
qui ne sont pas uniquement celles de la membrane, mais l'idée
de membrane plasmique existait déjà. Par contre la
cellule est toujours considérée comme un ensemble et
les propriétés du cytosol sont comparées
à celle d'un gel (modèle de gauche ci-dessous).
Certains chercheurs comme Hill (1930) eurent une influence
déterminante en présentant la cellule comme un milieu
liquide enfermé dans un petit sac semi-perméable (la
membrane plasmique) (modèle de droite ci-dessous). La notion
de pompe à Na+ date au moins de 1940 (Heppel) et les travaux
de Hodgkin (1952) furent
déterminants pour asseoir le modèle de pompe ionique.
Mais il ne faut pas oublier que Hodgkin travaille sur un axone
géant isolé (in vitro donc) et ultérieurement
sur des axones perfusés (Hodgkin, 1958). On est loin de la
cellule vivante. Il n'y a rien d'étonnant à ce que l'on
observe des propriétés membranaires si l'on
étudie plus qu'une cellule réduite à sa membrane
(et une mince couche de cytoplasme qui "colle" à celle-ci)
remplie d'une liquide contrôlé artificiellement. C'est
encore plus évident avec la technique du patch-clamp (voir
ci-dessous) ou encore avec l'utilisation d'hématies comme
modèles cellulaires.

Il est évident que ces deux modèles sont de toute façon simplistes si on considère l'extraordinaire complexité structurale du cytoplasme d'une cellule (on peut se référer à des ouvrages d'histologie structurale ou ultrastructurale cités en tête de page). L'axone n'est pas vide, il est même très encombré : reticulum, vésicules golgiennes en un incessant va et vient, microtubules et filaments variés, ribosomes "libres" (associés en polyribosomes, tout comme dans les corps de Nissl où ils alternent avec des ribosomes associés à des lamelles de reticulum disposées parallèlement...), mitochondries... Toutes les électronographies de qualité présentant des coupes longitudinales d'axone montrent bien cet encombrement (voir livres d'ultrastructures référencés ci-dessus par exemple).
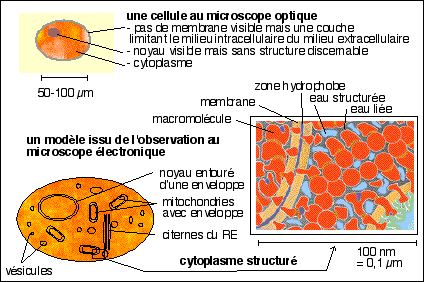
La membrane plasmique : les données de la
microscopie électronique permettent de considérer que
la membrane plasmique forme une double structure osmiophile
d'épaisseur variant entre 5 et 9 nm. Ses
spécialisations sont nombreuses, même au niveau des
neurones : synapses, liens étroits avec les cellules gliales
(dont les cellules de Schwann qui forment la gaine de
myéline...). ...le modèle actuel est toujours celui
d'une double couche phospholipidique de 5 nm
d'épaisseur asymétrique (les glycolipides sont
pointés habituellement vers le milieu extracellulaire), dont
la fluidité dépend essentiellement de la
teneur en cholestérol et de la présence de
protéines qui augmentent nettement l'épaisseur de
la membrane (intrinsèques si elles sont solidement
accrochées aux lipides et ne peuvent être extraites par
des traitements modérés (comme une modification du pH),
extrinsèques dans le cas contraire ; enchâssées
dans la couche lipidique (transmembranaires) et dépassent plus
ou moins ; périphériques au cas où elles
seraient juste accolées à l'une ou l'autre des faces de
la membrane).
Il ne faut pas oublier que la connaissance des protéines
membranaires passe souvent par leur extraction, purification,
cristallisation puis diffraction aux rayons X, afin de
déterminer leur structure tridimensionnelle. Il est
évident que les modèles proposés ne sont jamais
directement ceux des protéines en place ; je pense notamment
aux protéines-canaux dont nous allons parler ci-dessous. La
microscopie électronique permet aussi des voir les structures
osmiophiles après certains traitement fixateurs, on est
toujours dans le domaine d'une approche indirecte du vivant ; je
renvoie à des discussions simples mais essentielles du cours
de seconde (encore en cours d'élaboration...) sur les
moyens d'observation à la disposition du
biologiste. Il ne s'agit pas de dire que le vivant n'est pas
connaissable, il s'agit simplement de bien cadrer les limites de
chaque technique. La membrane plasmique est une structure qui n'est
pas observable à l'œil nu, toute technique qui la met en
évidence, ne permet qu'une approche partielle de sa structure.
Chaque nouvelle technique nous permet d'affiner le modèle,
mais il reste un modèle. Ne jamais oublier que la membrane
plasmique est l'interface entre la cellule vivante et le milieu
extérieur.
On sait depuis le début du XIXème siècle
(voir histoire de science : Bell et
Magendie et Du
Bois-Reymond et Matteuci) que des phénomènes
électriques sont associés à la transmission d'un
influx nerveux. Mais c'est surtout à partir des travaux
d'Alan Lloyd Hodgkin et Andrew
Fielding Huxley puis Katz, suivis par de nombreux autres
chercheurs, travaillant sur l'axone géant de calmar (et
aussi de crustacés), qu'une théorie membranaire ionique
a été élaborée. La troisième
étape dans l'avancée des connaissances en
électrophysiologie est marquée par l'utilisation de la
technique du voltage imposé ou voltage clamp qui permet
de contrôler finement les processus de genèse du
potentiel d'action en appliquant à la membrane de l'axone
géant un voltage de signe opposé à toute
variation du potentiel de membrane. Cette technique permet de mesurer
finement les courants d'ions à travers la membrane. Enfin ce
n'est que tout dernièrement que la technique du voltage
imposé à pu être appliquée à des
fragments de membranes conduisant à la variante du
patch-clamp mise au point par Edwin
Neher et Bet Sakmann (prix Nobel en 1991). Cette technique a
confirmé les résultats obtenus sur des axones
perfusés et conforté les hypothèses
émises sur le fonctionnement des canaux et pompes ioniques.
Les études cristallographiques des protéines
membranaires vont bon train et des progrès sont
réalisés en ce moment même.
Comme tout domaine à la pointe de la science notre
compréhension des mécanismes ioniques à la base
de la neurophysiologie sont à même d'être
modifiés dans un avenir proche. Aussi, réaliser une
synthèse est-il assez dangereux. Je voudrais cependant
m'efforcer de montrer ici l'évolution des idées,
directement liée à l'évolution des
techniques.
Questions de base :
D'où viennent la polarisation et l'excitabilité d'une
cellule nerveuse (ou musculaire...) et leur maintien dans le temps
?
Comment un potentiel d'action peut-il naître et être
entretenu par une cellule afin d'être propagé sans
atténuation ?
La plupart des cellules eucaryotes sont polarisées,
elle présentent une différence de potentiel
(d.d.p.) entre leur cytosol et le milieu extracellulaire : cette
d.d.p. est appelée potentiel de repos ou potentiel
de repos membranaire ou encore potentiel membranaire. Pour
éviter la confusion avec le potentiel de récepteur on
utilisera le sigle PRM. A la suite d'une stimulation on
observe un potentiel d'action (PA) qui est une
dépolarisation brusque suivie d'une inversion de polarisation,
puis un retour à la polarisation initiale souvent
précédée d'une légère
hyperpolarisation. Ce PA n'est pas observable sur toutes les cellules
et en tout point de la membrane : les cellules pouvant
générer ou/transporter des PA sont dites
excitables. Pour un élève de TS il est suffisant
de savoir que l'on peut le trouver au niveau des axones des neurones
et de la membrane plasmique des cellules musculaires striées
(appelé plasmalemme).
Ces mesures de potentiel sont mesurées avec des
électrodes doubles dont les principes et les limites de
fonctionnement ne sont pas neutres mais malheureusement sortent du
cadre de ce cours (voir quelques éléments de discussion
plus bas).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
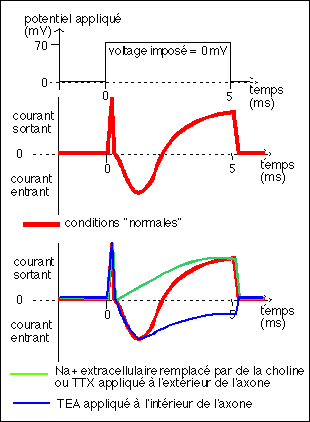
la TTX ou tétrodoxine est une toxine
isolée du foie et des ovaires du tétrodon, elle
annule la conductance au Na+,
l'ion TEA ou tétraéthyl ammonium bloque le
courant K+ uniquement lorsqu'il est appliqué à
l'intérieur de l'axone
Il n'y a pas d'unité sur l'axe des ordonnées mais
j'ai trouvé des valeurs de conductance de l'ordre de
quelques dizaines de milliSiemens par cm2.
Il faut ajouter que, pour les axones géants de Calmar et
chez divers Crustracés chez lesquels la méthode est
appliquée, on refroidit le milieu afin de ralentir les
processus chimiques en jeu. (Rieutort, p 101)
Voici l'analyse de ces courbes:
* courbe complète en
conditions normales
- dès l'application
du voltage annulant la dépolarisation membranaire, on
observe un courant sortant qui semble correspondre à la
décharge de la capacité membranaire (ce signal a
été enlevé de certaines courbes
présentées au baccalauréat)
- immédiatement fait suite un courant sortant, très
rapide, correspondant à la recharge de la capacité
membranaire,
- puis un courant entrant rapide qui atteint un maximum en
une fraction de la milliseconde
- enfin un courant sortant important , continu et
progressif qui ne cesse qu'à l'arrêt du voltage
imposé,
- l'arrêt du voltage imposé est suivi d'un retour
à un courant nul lié à la recharge de la
capacité membranaire.
* courbe avec le Na+
remplacé par de la choline dans le milieu
extracellulaire:
- après la décharge puis recharge de la
capacité membranaire, immédiate
- le courant observé est alors uniquement un courant
sortant progressif et continu. Ce courant est
INTERPRÉTÉ comme un flux d'ions K+ sortant.
* courbe avec la TTX (tétrodotoxine), connue pour supprimer
les transferts membranaires de Na+ (on dit couramment qu'elle
"bloque les canaux sodium" mais en fait il existe beaucoup
d'autres interprétations sur les mécanismes qui lui
permettraient d'empêcher les transferts de sodium). Cette
courbe est la même que la précédente.
* courbe avec l'ion TEA
(tétraéthylammonium),
connu pour bloquer sélectivement les transferts de
potassium. Le TEA n'agit que s'il est appliqué à
l'intérieur de l'axone de Calmar.
- la courbe obtenue, après décharge et recharge de
la capacité membranaire, est celle d'un courant entrant
rapide qui atteint son maximum en une fraction de
milliseconde,
- suivi par un courant sortant progressif et continu qui ne
cesse qu'à l'arrêt de l'imposition du voltage. Ce
courant est INTERPRÉTÉ comme un flux de Na+ entrant
massivement dans l'axone, suivi par une sortie progressive.
-
Les concentration ioniques (en mmol.L-1 = mM) mesurées chez le calmar par Hodgkin (1955) sont données dans le tableau ci-dessous avec pour comparaison les valeurs classiques des concentrations intracellulaires (intra-) et extracellulaires (extra-) pour une cellule de mammifère (in Biologie moléculaire de la cellule, tableau 11-1) :
|
|
|
|
|
||
|
cytoplasme |
sang |
intra- |
extra- |
||
|
K+ (potassium) |
400 |
20 |
|
|
|
|
Na+ (sodium) |
50 |
450 |
|
|
|
|
Cl- (chlorure) |
40 |
570 |
|
|
|
|
Ca2+ (calcium) |
très faible pour le Ca libre |
10 |
|
|
|
|
Mg2+ (magnésium) |
10 |
55 |
|
|
|
Remarque importante :
lorsque l'on arrache à une cellule un fragment de membrane il
est évident que la membrane n'est pas seule
mais comporte une couche de cytoplasme qui
adhère à sa face interne. De la manière,
la face externe comporte des éléments du milieu
extracellulaire. Les propriétés d'une membrane
biologique isolée ne sont jamais celles d'une membrane
théorique. C'est pour cela que les interprétations qui
ne tiennent compte que de la double couche phospholipidiques et des
protéines du modèle sont insuffisantes pour
décrire la membrane biologique, même supposée
"isolée".
|
K+ |
Cl- |
Na+ |
Ca2+ |
|
1 |
0,45 |
0,04 |
0 |
Les courbes sont données dans le Bordas p 42-43 et le Nathan p 29. Je n'ai pas le temps de me référer aux publications originales mais il est évident qu'il y a un problème avec les courbes du Bordas. Peut-on réellement isoler un fragment de membrane avec un seul type supposé de canaux (alors que leur existence n'est même pas prouvée) ? Je pense que l'équipe du Bordas a souhaité simplifier les résultats dans un but pédagogique et que les courbes présentées sont obtenues avec la TTX et le TEA, comme cela est correctement présenté dans le Nathan...
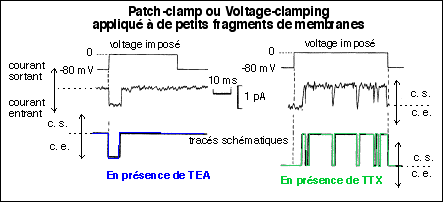
En présence de
TEA le courant entrant
immédiat est interprété comme une entrant
massive de Na+ qui persiste pendant enviton 6 ms. Il est suivi par
un arrêt complet du courant entrant malgré la
persistance du voltage imposé.
En présence de
TTX, le courant sortant
qui est mesuré apparaît avec un délai de
quelques millisecondes. Cette phase est suivie d'une persistance
du courant sortant à sa valeur maximale pendant toute la
durée de l'application du voltage imposé. Cependant
des brefs épisodes de courant entrant suivi par un courant
sortant compensateur apparaissent au cours de cette phase
d'apparente stabilité. Ces courants sortants sont
interprétés comme des sorties de
K+.
La modélisation chimique se base d'une part sur
l'équation de Nernst qui prédit dans un modèle
simple à un seul ion la répartition de cet ion de part
et d'autre d'une membrane semi-perméable et d'autre part sur
les travaux de Goldman (1943) qui aboutit à l'équation
dite de Goldman et qui tient compte de la présence
simultanée de plusieurs ions (mais qui repose en
définitive aussi sur l'équation de Nernst).
Pour ne pas passer trop de temps à ce qui n'est qu'un
modèle purement électrochimique et non biologique on
peut résumer les résultats en quelques points (calculs
réalisés à partir des valeurs de
perméabilité et de concentration ioniques de l'axone de
calmar et très bien présentés pour ce que j'en
comprends dans le Nathan p 24-25) :
Globalement la membrane théorique se comporte donc comme si elle était perméable au Cl-, faiblement perméable au Na+ (qui rentre peu) et fortement perméable au K+ (qui sort un peu du fait de son mouvement à contre gradient) ; le flux de Na+ étant supérieur à celui du K+ dans un rapport d'environ 3/2.
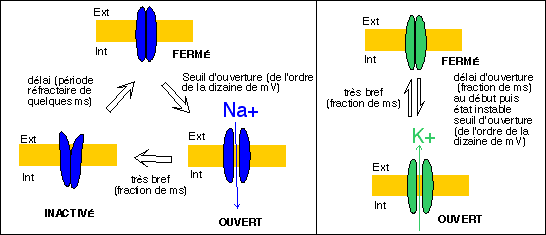
Le modèle électrochimique pour le potentiel d'action est directement déduit des résultats obtenus à partir des techniques de voltage imposé. Lors d'un PA, la perméabilité au Na+ augmente brusquement et transitoirement (moins d'1 ms). Avec un décalage, d'une durée de l'ordre de la fraction de ms, la perméabilité au K+ augmente à son tour. L'entrée du Na+, dans le sens du gradient éléctrique et de du gradient de concentration, est responsable de la brusque dépolarisation membranaire. La sortie retardée du K+ est responsable de la repolarisation et de l'hyperpolarisation transitoire.
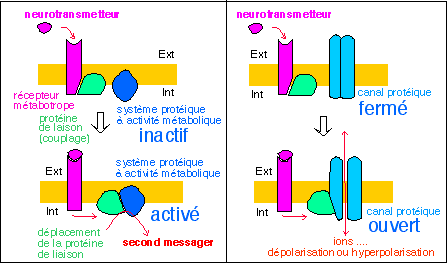
Nous ne nous intéresserons qu'aux seules synapses chimiques, qui mettent en jeu la libération d'un neurotransmetteur.
Dans le cadre de la théorie membranaire on suppose l'existance de de canaux calciques (à Ca2+) voltage-dépendants (réglés par la tension) dont voici un modèle illustratif.
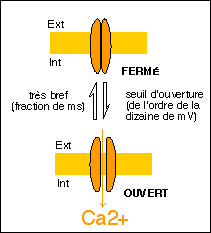
Le Ca2+ libre dans la cellule est quasiment inexistant (moins de 10-7 M) car il est toujours lié à des protéines fixatrices (calmoduline, qui est considérée comme un récepteur intracellulaire du Ca2+) ou stocké dans des compartiments comme des vésicules golgiennes (ou les saccules du reticulum (citernes) dans la cellule musculaire striée par exemple, ou encore les mitochondries).
On pense donc que le Ca2+ serait LE signal qui permettrait le passage d'un PA à une variation de concentration ionique dans la cellule (ce que ne font pas les éventuels canaux Na+ et K+ qui ne modifient que des potentiels de membrane et non des concentrations cytoplasmiques). Le Ca2+ jouerait alors le rôle d'un second messager dans le sens où il activerait divers mécanismes enzymatiques conduisant notamment à l'exocytose des vésicules synaptiques (mécanismes variés encore mal connus faisant intervenir des protéines de laison : les annexines, et des protéines de fusion...).
En absence de précisions, il semble que le signal Ca2+ soit considéré comme la seule explication valable au changement de nature du signal ("transduction" d'un signal électrique (ddp) en signal chimique (concentration ionique) ), généralisée pour toutes les synapses chimiques.
Les notions de "canal voltage-dépendant" et de "canal
chimiodépendant" me semblent inutiles car de toute
façon, actuellement, un seul type de canal, le
récepteur-canal à Ach, donc chimiodépendant,
semble avoir été trouvé avec certitude. Nous
préfererons donc la terminologie liée aux types de
récepteur.
On considère actuellement qu'il existe deux types des
récepteurs qui ne s'excluent pas l'un l'autre pour un type de
neurotransmetteur ...:
|
|
|
|
|
|
acétylcholine |
|
|
GABA |
Substance P |
|
glutamate |
|
|
aspartate |
Met-enképhaline * Leu-enképhaline |
|
glycine |
|
|
(@ désigne un cycle aromatique en C6): Tyrosine ---> Dopa ---> Dopamine ---> NAdr OH-@-CH2-CHCOOHNH2 |
|
|
|
|||
|
|
|
||
|
|
|
|
|
|
canaux de fuite toujours
ouvert à Na+ et K+ |
génèse du potentiel membranaire de repos (PRM) des cellules esxcitables |
récepteur (à ACh) canal ionotropique à Na+ (Ca2+ et K+) |
PPSE de la jonction neuromusculaire (potentiel de plaque) et d'autres synapes rapides à ACh |
|
Remarque: |
|||
|
canaux voltage dépendants (réglés par la tension) à Na + et à K+ |
génèse et maintien du potentiel d'action (PA) |
||
|
canal voltage dépendant (réglé par la tension) à Ca2+ |
signal calcium (exocytose des vésicules synaptiques...) |
||
|
canaux chimiodépendants ou récepteurs canaux métabotropiques inhibiteurs (à Cl-) ou excitateurs ( à Na+) |
PPSE et PPSI des membranes postsynaptiques |
||
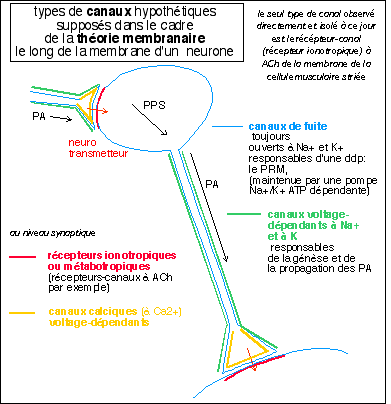
Pour un neurone central recevant d'innombrables afférences la théorie actuelle considère que c'est le corps cellulaire qui somme (intégre) les PPS inhibiteurs et excitateurs essentiellement au niveau du cône axonal ou cône d'implantation (axone hillock) où est reçu le PPS global à in instant donné. La propagation des PPS reste assez mystérieuse mais semble très rapide mais par contre l'amplitude du signal semble s'atténuer rapidement dès que l'on s'èloigne du lieu de leur naissance. On explique la naissance d'un PA, à partir d'un certain seuil, par la présence en ce seul endroit (du corps cellulaire et des dendrites car bien évidemment ils seraient présents tout le long de l'axone) des "canaux voltage-dépendants" responsables de la génèse et de la propagation du PA.
Des études fines sur le cône axonal on fait découvrir en fait plusieurs types de perméabilités ioniques en rapport avec la dépolarisation membranaires :
Les données cytologiques sont rares pour l'homme mais, du
fait de l'unité du vivant, il est intéressant de
présenter des comparaisons avec les organismes chez qui
certaines structures ont été mises en évidence
:
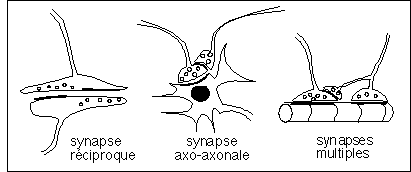
* des synapses réciproques (dans les deux sens)
dendro-dendritiques par exemple chez certains Cnidaires (au niveau
d'une même zone de contact synaptique on observe des
vésicules synaptiques dans les deux zones qui se font face :
on pense que la transmission d'un influx nerveux peut se faire dans
l'un et l'autre sens)
* des synpases axo-axonales qui sont interprétées comme
des synpases modulées par d'autres synpases
* des synapses multiples : pour une même cellule nerveuse des
terminaisons entrent en contact avec plusieurs types de cellules
différents comme par exemple certaines fibres musculaires de
crustacés.
Les données expérimentales sont encore très
fragmentaires et sur des matériels très
hétéroclites :
* le modèle de prédilection des neurophysiologistes a
longtemps été l'Aplysie, un petit Mollusque
Gastéropode marin qui peut atteindre une vingtaine de
centimètres de long. Le mécanisme étudié
est celui de la rétraction du siphon qui, après une
série de stimulation répétée,
présente une accoutumance qui peut être supprimée
par un choc ou un bruit violent. L'animal devenant alors
sensibilisé car il reste sensible à un contact. Ceette
étude est franchement hors-programme (Voir Biologie
Moléculaire de la cellule par exemple). On connaît aussi
chez l'Aplysie un comportement que l'on qualifie d'apprentissage
associatif qui est une liaison mémorisée de deux
stimuli différents.
* la drosophile présente elle des mutants chez qui on retrouve
cette interprétation d'apprentissage associatif entre un choc
électrique et une odeur....
* chez les mammifères les études sont innombrables et
divergentes ; l'hippocampe, région du cortex
cérébral, semble jouer un rôle particulier dans
l'apprentissage... Un mécanisme classique est celui de la
transmission de la douleur au niveau de la moelle
épinière mais le modèle présentant la
substance P comme neuromédiateur est fortement remis en
question. On trouvera un dossier très bien fait sur le site de
l'INRP: www.inrp.fr/Acces/biotic/neuro/douleur/accueil.htm.
Il semblerait que le neurotransmetteur principal soit le glutamate,
assurant une transmission rapide de l'information douloureuse depuis
le neurone sensitif (NS) jusqu'au neurone médullaire (NM)
ayant des prolongements vers l'encéphale. Le contrôle se
ferait par des neurones de contrôle (NC) en relation avec des
neurones centraux cérébraux et par
l'intermédiaire de neuromodulateurs du type
enképhalines qui seraient libérées soit au
niveau de la terminaison présynaptique (NS-NM) soit au niveau
du corps cellulaire du neurone post-synaptique (NM). La substance P
interviendrait essentiellement dans la modulation de la transmission
NS-NM sans que l'on sache exactement comment.
Les données biochimiques sont là encore
difficilement accessibles pour des non spécialistes. La
plupart des études font référence à des
maladies qualifiées de psychiques et les modèles
utilisés sont des modèles psychologiques, quand ils ne
sont pas psychanalytiques. On est souvent loin de la biologie.
Pour un élève de terminale il est simplement
nécessaire de comprendre que la plupart des substances
chmiques utilisées actuellement soit comme stupéfiants
soit comme médicaments dits "de l'esprit", semblent tous agir
notamment sur la synapse. Je vous renvoie aux pages du Bordas (46-47)
et Nathan (44-45, 46-47).
Le programme mal défini est encore une
fois traité par raccroc de façon inadaptée et
sans vision d'ensemble du fait du peu de cohérence des
connaissances actuelles... L'effort fait par les manuels est louable.
Mais le fait que des documents de ce type soit tombés et bac
alors qu'ils ne nécessitaient qu'une unique LECTURE par les
candidats sans aucune réflexion sur les techniques ou sur les
résultats montre combien l'exercice de type bac
s'éloigne du domaine expérimental. C'est fort
regrettable.
Conclusion
Il faut encore et toujours revenir aux cellules. Si l'on veut un jour
comprendre de façon plus approfondie le fonctionnement du
neurone, il faut revenir à des concepts de base : le neurone
naît, croît et vit, puis meurt. De plus, il n'est pas
seul mais il fait partie d'un système de cellules de
même origine et de même fonction, et enfin il appartient
à un organisme.
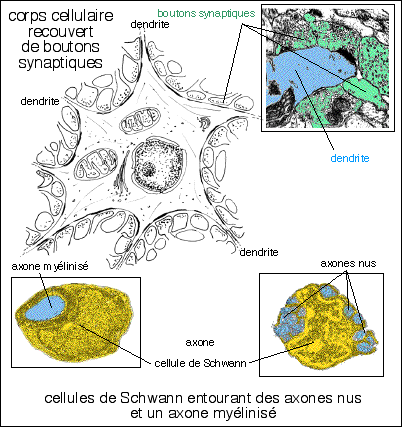 |
et électronographies (extraites de Biologie moléculaire de la cellule, Alberts et al., volontairement très modifiées afin d'éviter une autre utilisation que celle d'illustration de mon propos) présentant :
|
Le tissu nerveux, neurones et cellules gliales, forme un tissu
spécialisé, d'origine embryonnaire qui semble
très délimitée (cellules souches du tube et des
crêtes neurales), les interations entre cellules, notamment
pendant la période de croissance et de maturation du
système nerveux chez l'enfant, sont déterminantes . Les
synapses sont des structures dynamiques qui s'établissent et
dégénérent en permanence (guidées en cela
- semble-t-il - au moins par la lame basale (collagène) et par
les cellules gliales). Un neurone, du fait de ses prolongements
(neurites), occupe un voulme qui peut être des milliers ou des
dizaines de milliers de fois plus important qu'une autre cellule
comme un hépatocyte... Les problèmes de renouvellement
moléculaire et de transport axonal sont essentiels (on
connaît des transports rapides par l'intermédiaire de
vésicules et de protéines contractiles migrant soit du
corps cellulaire vers les terminaisons axonales à des vitesses
de quelques 40 centimètres par jour, soit dans le sens
inverse, vers le corps cellulaire, plus lentement, typiquement
à des vitesses de 20 à 30 centimètres par jour).
On a aussi mis en évidence un transport axonal lent de l'ordre
de quelques millimètres par jour par l'intermédiaire
des protéines du cytosquelette. Actuellement on pense que plus
de 50% des neurones formés au cours du développement
embryonnaire meurent après avoir établi des contacts
avec leurs cellules cibles. On en revient aux mécanismes de
développement proposés par exemple par Rosine
Chandebois avec la progression autonome : la mémoire
cellulaire enregistre l'environnement à un instant
donné, qui disparaît ensuite mais laisse des traces qui
sont autant de déterminants du développement futur de
l'embryon.
Si l'on voulait comparer le tissu nerveux au tissu immunitaire
(dynamique, coordonné et évolutif) du cours
d'enseignement général (voir immunologie),
on pourrait dire que le système nerveux est en
perpétuel renouvellement, plastique (en
perpétuel remaniement), éducable,
fragile et à durée de vie limitée.
La communication nerveuse n'est pas (seulement) une communication
chimique ou/et ionique mais c'est avant tout une communication
cellulaire.
Et puis une idée de dernière minute, ce matin (1/04) en
cours... il y a de grandes absentes dans tous les modèles
proposés : les cellules gliales ; on retrouve des
cellules gliales le long de tous les neurones, y compris au niveau
synaptique, et leur rôle est loin d'être
élucidé (le rôle dans la migration des cellules
nerveuses au cours de la maturation du sytème nerveux chez
l'embryon et le rôle des cellules de Schwann dans les fibres
myélinisées est certainement un point
intéressant mais on est loin d'avoir une vue d'ensemble...)
voilà des pistes de recherche...
L'article "Un cristal riche d'enseignements" (Cécile Klingler,
La Recherche, 347, Novembre 2001, 20-21) est illustré par le
premier schéma que je vois dans un ouvrage de vulgarisation
où les cellules gliales participent à la recapture et
à la dégradation de l'acétylcholine grâce
à la sécrétion d'une protéine (AChBP: ACh
Binding Protein).. chez Lymnæa stagnalis.